
Struktura, funkcje i inhibitory acetylocholinoesterazy
Plik acetylocholinoesteraza (hydrolaza acetylocholinoacetylowa, EC 3.1.1.7) jest enzymem występującym głównie w ośrodkowym układzie nerwowym. Jej zadaniem, jak sama nazwa wskazuje, jest hydrolityczna obróbka neuroprzekaźnika acetylocholiny..
Jest to enzym związany z błoną komórkową, który współpracuje z receptorem acetylocholiny, pośrednicząc w pobudzaniu komórek postsynaptycznych i którego mechanizm katalityczny jest zaskakująco szybki.
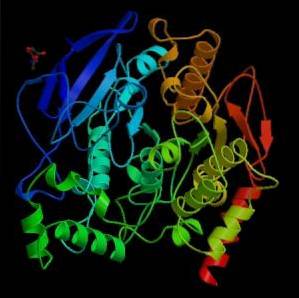
Z mechanicznego punktu widzenia enzym ten można postrzegać jako hydrolazę serynową, aw domenie katalitycznej swojego miejsca aktywnego zawiera triadę aminokwasów charakterystycznych dla proteaz serynowych: serynę, histydynę i resztę kwasową. Jednak kwasową resztą jest glutaminian, podczas gdy proteazy serynowe zwykle posiadają asparaginian..
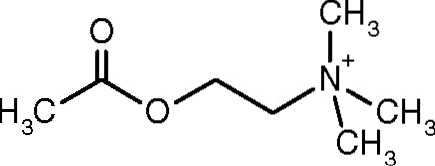
Jedną z pierwszych obserwacji, która wiązała aktywność katalityczną acetylocholinoesterazy z cholinergicznymi tkankami nerwowymi i tkankami mięśniowymi, dokonał Dale w 1914 roku; później ustalono, że występuje również w neuronach niecholinergicznych oraz w komórkach krwiotwórczych, osteogennych i nowotworowych.
Dzięki badaniu różnych organizmów obecnie wiadomo, że enzym występuje w błonie różnych typów komórek, takich jak erytrocyty, komórki nerwowe i mięśniowe, narządy elektryczne i inne..
Indeks artykułów
- 1 Struktura
- 1.1 Struktura trzeciorzędowa i czwartorzędowa
- 1.2 Struktura podstawowa
- 2 Funkcje
- 3 Inhibitory
- 3.1 Nieodwracalne inhibitory
- 3.2 Odwracalne inhibitory
- 3.3 Butyrylocholinesteraza
- 4 Acetylocholinesteraza i choroba Alzheimera
- 5 Referencje
Struktura
Struktura trzeciorzędowa i czwartorzędowa
W warunkach naturalnych lub „in vivo ”, acetylocholinoesteraza jest polimorficznym enzymem, który składa się z kilku katalitycznych podjednostek mniej więcej 80 kDa, które łączą się, tworząc strukturę oligomeryczną (z kilku podjednostek).
Ilość i złożoność tych podjednostek zależy od typu komórki i rozpatrywanego gatunku..
Niektóre z bardziej złożonych form enzymów mają podjednostki katalityczne z formami kulistymi (G) lub asymetrycznymi (A) połączonymi mostkami dwusiarczkowymi. Mostki dwusiarczkowe są wiązaniami kowalencyjnymi utworzonymi między dwiema cząsteczkami siarki grup tiolowych (-SH) dwóch reszt aminokwasu cysteiny.
Każda podjednostka G zawiera pojedyncze miejsce aktywne, podczas gdy podjednostki A ogólnie charakteryzują się trzema domenami strukturalnymi, a mianowicie: podjednostkami katalitycznymi, ogonami kolagenopodobnymi bogatymi w reszty glicyny, hydroksyproliny i hydroksylizyny oraz innymi. Kleje niekolagenowe (inne niż kolagen).
Asymetryczne formy acetylocholinoesterazy są znane jako A12, A8 i A4, które mają odpowiednio 12, 8 i 4 podjednostki katalityczne..
Ogólnie, reszty domeny katalitycznej w miejscu aktywnym znajdują się w „głębokim” regionie podjednostek, co może być postrzegane jako sprzeczne w odniesieniu do szybkiego tempa reakcji katalizującej ten enzym i pozornej niedostępności substratu do tych witryn..
Niezależnie od polimorfizmu enzymu, zarówno podjednostki globularne, jak i asymetryczne mają podobną aktywność katalityczną..
Warianty
Niektóre komórki inne niż komórki nerwowe, takie jak erytrocyty, wytwarzają głównie globularne, dimeryczne enzymy acetylocholinoesterazy, związane głównie z zewnętrzną powierzchnią błony komórkowej..
Enzym erytrocytów, chociaż ma mniejszą złożoność strukturalną, jest również enzymem amfipatycznym, którego aktywna domena katalityczna znajduje się w dużym regionie hydrofilowym, podczas gdy domena hydrofobowa, która zawiera region końca karboksylowego, jest odpowiedzialna za utrzymanie go w błonie.
Struktura podstawowa
Duża część aktualnej wiedzy na temat sekwencji acetylocholinoesterazy pochodzi z badań tego enzymu Torpeda Californica, płaszczka żyjąca na Oceanie Spokojnym, tradycyjnie wykorzystywana jako organizm modelowy do badania różnych białek układu nerwowego.
Podjednostki acetylocholinoesterazy są syntetyzowane jako probiałka, które są następnie przetwarzane w celu uzyskania dojrzałych podjednostek. Każda podjednostka składa się z polipeptydu o około 575 aminokwasach i masie cząsteczkowej 65 kDa, która jest zwiększana przez dodanie 7-8% reszt węglowodanowych (glikozylacja)..
Aktywność katalityczną centrum aktywnego podjednostek określa reszta seryny w pozycji 200, która znajduje się w „głębokim” regionie podjednostek katalitycznych..
W organizmach istnieją różne warianty lub izoformy enzymu dzięki różnym lokalizacjom „alternatywny splicing " pre-messenger RNA na obu końcach (5 'i 3'). Sekwencja końca karboksylowego izoformy każdej podjednostki jest tym, co określa połączenie oligomerów ze sobą..
funkcje
Acetylocholinoesteraza jest enzymem o wielu funkcjach biologicznych, które niekoniecznie są ze sobą powiązane. Fakt potwierdzony przez jego zróżnicowaną ekspresję podczas embriogenezy, rozszerzenia nerwów embrionalnych, rozwoju mięśni i synaptogenezy.
Jak podkreślono powyżej, odgrywa ważną rolę w szybkiej hydrolizie acetylocholiny, a zatem w regulacji jej działania w przestrzeni synaps nerwowo-mięśniowej lub w cholinergicznych przestrzeniach synaptycznych ośrodkowego układu nerwowego..
Przykładem jego funkcji jest skurcz mięśni szkieletowych, który zachodzi dzięki rodzajowi synapsy chemicznej zwanej płytką motoryczną, zlokalizowanej pomiędzy neuronem ruchowym a włóknem mięśniowym..
W tej synapsie powstają setki pęcherzyków obciążonych acetylocholiną, które są uwalniane z neuronu ruchowego w celu propagacji impulsu elektrycznego..
Ten proces neuroprzekaźnictwa jest dość złożony, jednak udział acetylocholinoesterazy ma kluczowe znaczenie dla zakończenia transmisji synaptycznej, która zależy od neuroprzekaźnika acetylocholiny, ponieważ musi zostać zdegradowana, a następnie musi dyfundować poza szczelinę synaptyczną, aby osiągnąć kulminację ze wzbudzeniem błony..
Zatem enzym acetylocholinoesteraza jest odpowiedzialny za regulację stężenia tego przekaźnika w synapsie neuromotorycznej..
Inne „nieklasyczne” funkcje enzymu są związane z neurytogenezą lub wzrostem komórek nerwowych; m.in. z procesami adhezji komórek, synaptogenezy, aktywacją neuronów-dopaminy w istocie czarnej śródmózgowia, procesami krwiotwórczymi i skrzepliną poetyczną, m. in..
Inhibitory
Inhibitory acetylocholinoesterazy działają zapobiegając hydrolizie acetylocholiny, zwiększając w ten sposób poziom i czas działania tego neuroprzekaźnika. Ze względu na mechanizm ich działania można je sklasyfikować jako odwracalne i nieodwracalne.
Nieodwracalne inhibitory
Są to takie, które nieodwracalnie hamują hydrolityczną aktywność acetylocholinoesterazy poprzez jej kowalencyjne wiązanie z resztą seryny w miejscu aktywnym enzymu. Ta grupa składa się głównie z organofosforanów.
Na ogół są to związki czynne obecne w wielu środkach owadobójczych i odpowiedzialne za dużą liczbę przypadkowych zgonów spowodowanych zatruciem. Są to estry lub tiole pochodzące z kwasu fosforowego, fosfonowego, fosfinowego lub fosforoamidowego.
Sarin, tabun, soman i cyklosaryna należą do najbardziej toksycznych związków syntetyzowanych przez człowieka, ponieważ mogą zabić człowieka poprzez wywołanie niewydolności oddechowej i krążenia poprzez blokowanie acetylocholinoesterazy w obwodowym układzie nerwowym..
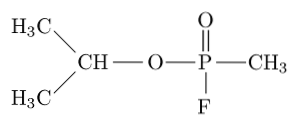
Na przykład Sarin jest „gazem paraliżującym” używanym jako broń chemiczna do celów terrorystycznych..
Odwracalne inhibitory
Ta kolejność klasyfikacji grupuje konkurencyjne i niekonkurencyjne inhibitory, które działają poprzez przejściową i odwracalną karbamylację reszty seryny w miejscu aktywnym i wiele z nich zsyntetyzowano i oczyszczono ze źródeł roślinnych lub grzybowych..
Karbaminiany, takie jak fizostygmina i neostygmina, są odwracalnymi inhibitorami, które są stosowane jako leki w leczeniu chorób, takich jak odpowiednio jaskra i miastenia..
Inne środki lecznicze z tej grupy są również stosowane w leczeniu choroby Alzheimera, choroby Parkinsona, pooperacyjnych niedrożności jelit (pooperacyjna niedrożność jelit), wzdęcia pęcherza oraz jako odtrutki w przypadku przedawkowania leków przeciwcholinergicznych..
Butyrylocholinesteraza
Ciekawy naturalny mechanizm przeciwko niektórym substancjom hamującym acetylocholinoesterazę ma związek z udziałem mniej specyficznego enzymu znanego jako butyrylocholinoesteraza.
Enzym ten jest również zdolny do hydrolizowania acetylocholiny, a jednocześnie może działać jako wabik molekularny, który reaguje z tymi toksynami, zanim wywrą negatywny wpływ na acetylocholinoesterazę..
Acetylocholinesteraza i choroba Alzheimera
Wykazano, że acetylocholinoesteraza tworzy stabilny kompleks ze składnikami płytek starczych charakterystycznych dla danej patologii. Ponadto niektóre zmienione wzorce glikozylacji tego enzymu zostały powiązane z obecnością i tworzeniem się blaszek amyloidowych w mózgu..
Dlatego też wiele odwracalnych inhibitorów acetylocholinoesterazy stosowano jako leki pierwszej generacji do leczenia tej choroby i innych powiązanych schorzeń neurodegeneracyjnych. Należą do nich donepezil, rywastygmina i galantamina..
Bibliografia
- Dvir, H., Silman, I., Harel, M., Rosenberry, T. L., & Sussman, J. L. (2010). Acetylocholinoesteraza: od struktury 3D do funkcji. Interakcje chemiczno-biologiczne, 187, 10-22.
- Houghton, P., Ren, Y. i Howes, M. (2006). Inhibitory acetylocholinoesterazy z roślin i grzybów. Raporty o produktach naturalnych, 2. 3, 181-199.
- Krsti, D. Z., Lazarevi, T. D., Bond, A. M. i Vasi, V. M. (2013). Inhibitory acetylocholinoesterazy: farmakologia i toksykologia. Obecna neurofarmakologia, jedenaście, 315-335.
- Mukherjee, P. K., Kumar, V., Mal, M., & Houghton, P. J. (2007). Inhibitory acetylocholinoesterazy z roślin. Fitomedycyna, 14, 289-300.
- Quinn, D. M. (1987). Acetylocholinesteraza: struktura enzymu, dynamika reakcji i wirtualne stany przejściowe. Chem. Rev., 87, 955-979.
- Racchi, M., Mazzucchelli, M., Porrello, E., Lanni, C., & Govoni, S. (2004). Inhibitory acetylocholinoesterazy: nowe działanie starych cząsteczek. Badania farmakologiczne, pięćdziesiąt, 441-451.
- Rosenberry, T. (1975). Acetylocholinoesteraza. Postępy w enzymologii i pokrewnych dziedzinach biologii molekularnej, 43, 103-218.
- Soreq, H. i Seidman, S. (2001). Acetylocholinoesteraza - nowe role dla starego aktora. Recenzje natury, dwa, 294-302.
- Talesa, V. N. (2001). Acetylocholinoesteraza w chorobie Alzheimera. Mechanizmy starzenia się i rozwoju, 122, 1961-1969.



Jeszcze bez komentarzy