
Podłoże, przygotowanie i zastosowanie agaru Hektoen

Plik Agar Hektoen lub dojelitowy agar Hektoen jest stałą, selektywną i różnicującą pożywką hodowlaną. Został stworzony w Instytucie Hektoen przez Kinga i Metzgera do izolacji bakterii enteropatogennych z rodzajów Shigella i Salmonella.
Pożywka składa się z peptonu proteozy, ekstraktu drożdżowego, soli żółciowych, laktozy, sacharozy, salicyny, tiosiarczanu sodu, chlorku sodu, cytrynianu żelaza, cytrynianu amonu, błękitu bromotymolowego, kwaśnej fuksyny i agaru. Formuła ta umożliwia odróżnienie rodzaju Shigella i Salmonella od pozostałych bakterii zdolnych do wzrostu w tym podłożu..
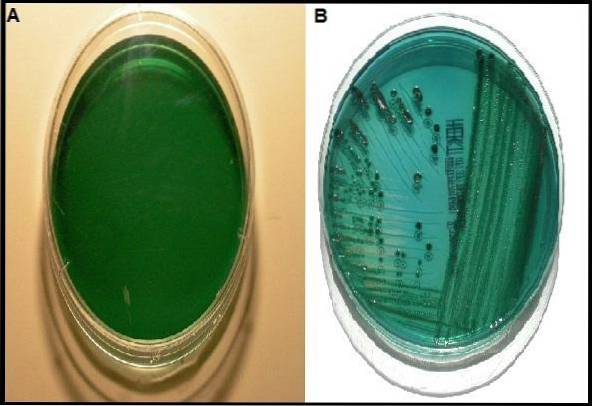
Chociaż istnieją inne podłoża o tej samej funkcji co agar Hektoen, ma on większą przewagę w porównaniu z innymi podłoży, zwłaszcza gdy chcesz odzyskać gatunki Shigella..
Gatunki obu płci powodują poważne problemy żołądkowo-jelitowe u ludzi z powodu spożycia skażonej żywności; dlatego przenoszenie odbywa się z kałem - ustnie. Dlatego stosowanie agaru Hektoen jest wskazane głównie w analizie mikrobiologicznej próbek kału i pokarmu..
Indeks artykułów
- 1 Uzasadnienie
- 2 Przygotowanie
- 3 Użyj
- 4 Kontrola jakości
- 5 Ograniczenia
- 6 Odnośniki
Podstawa
Agar Hektoen zawiera peptony i wyciąg z drożdży jako źródło składników odżywczych, dostarczających niezbędnych elementów do rozwoju drobnoustrojów.
Jednak zawiera również sole żółciowe, które działają poprzez hamowanie wzrostu niektórych bakterii, zwłaszcza Gram-dodatnich i niektórych Gram-ujemnych. Z tego powodu uważane jest za podłoże selektywne.
Z drugiej strony agar Hektoen jest pożywką różnicującą. Ta właściwość jest nadawana przez obecność ulegających fermentacji węglowodanów, takich jak laktoza, sacharoza i salicyna, wraz z systemem wskaźnika pH, reprezentowanym przez błękit bromotymolowy i kwaśną fuksynę..
Wszystkie bakterie zdolne do wzrostu na tym podłożu, które nie należą do rodzaju Salmonella i Shigella, będą rozwijać kolonie łososia lub pomarańczy, z wyjątkiem rodzaju Proteus. Wynika to z fermentacji jednego lub więcej obecnych węglowodanów, która zakwasza pożywkę, co powoduje zmianę wskaźnika pH..
Ze swojej strony rodzaje Shigella i Salmonella nie są zdolne do fermentacji żadnego z obecnych węglowodanów, wykorzystując tylko peptony jako źródło energii, które alkalizują podłoże, a zatem ich kolonie są niebiesko-zielone.
W środowisku tym można również wyróżnić bakterie zdolne do tworzenia siarkowodoru (bezbarwnego gazu). Źródłem siarki jest tiosiarczan sodu, a czynnikiem wywołującym jest cytrynian żelaza. Oba związki umożliwiają tworzenie się czarnego osadu siarczku żelaza, który świadczy o przebiegu reakcji.
Czarny osad w środku kolonii z przezroczystą aureolą dookoła daje efekt rybiego oka. Ta cecha sugeruje obecność rodzaju Salmonella.
Wreszcie chlorek sodu utrzymuje równowagę osmotyczną, a agar nadaje pożywce stałą konsystencję..
Przygotowanie
Odważyć 76 g odwodnionej pożywki i rozpuścić w litrze wody destylowanej. Energicznie wstrząśnij miksturą, a następnie odstaw na 10 do 15 minut. Można go podgrzewać i gotować, wykonując ruchy obrotowe aż do całkowitego rozpuszczenia. To podłoże nie jest autoklawowane.
Gdy pożywka osiągnie temperaturę około 45 ° C, przelać objętość 20 ml bezpośrednio na sterylne szalki Petriego..
Agar pozostawia się do zestalenia. W tym czasie są gotowe do użycia. Zaleca się ich natychmiastowe użycie. Jeśli nie jest to możliwe, do momentu użycia są przechowywane w lodówce..
Talerze należy wcześniej wyjąć z lodówki przed wysianiem, aby ogrzały się do temperatury pokojowej.
PH pożywki powinno wynosić 7,5 ± 0,2. Odwodnione podłoże ma kolor purpurowy, a przygotowane podłoże jest brązowozielone.
Posługiwać się
Do poszukiwania bakterii z rodzaju Shigella i Salmonella w próbkach kału i pożywienia zaleca się stosowanie agaru Hektoen..
Możliwość wyizolowania tych bakterii jest znacznie zwiększona, jeśli próbka zostanie wcześniej wzbogacona w specjalne buliony, takie jak bulion selenitowy, bulion cystynowo-selenitowy, bulion tetrationianowy itp..
Inokulum musi być mocne, a wysiew musi być wykonywany przez pasmowanie. Płytki inkubuje się w temperaturze 37 ° C przez 24 do 48 godzin w aerobiozie.
Zaleca się inkubację przez 48 godzin, ponieważ charakterystyka kolonii jest obecnie wyraźniejsza pod względem ich interpretacji i różnicowania..
QA
Aby przeprowadzić kontrolę jakości na tym podłożu, stosuje się certyfikowane szczepy bakterii, takie jak: Salmonella typhimurium ATCC 14028, Salmonella enteritidis ATCC 13076, Shigella flexneri ATCC 12022 i Shigella sonnei ATCC 25931.
Oczekiwane rezultaty są następujące: Salmonella typhimurium i Salmonella enteritidis powinny tworzyć niebiesko-zielone kolonie z czarnym środkiem lub bez niego. Podczas gdy gatunki Shigella będą rosły jako zielono-niebieskawe kolonie.
Szczepy Escherichia coli ATCC 29212, Proteus mirabilis, Klebsiella pneumoniae ATCC 700603, Enterococcus faecalis ATCC 29212 i Staphylococcus aureus ATCC 25923.
W takich przypadkach obserwowane cechy są następujące: E coli Y K. pneumoniae kolonie rozwiną się w tym medium w kolorze łososiowym do pomarańczowego, z osadami tego samego koloru wokół. Natomiast Proteus wytworzy niebiesko-zielone kolonie z czarnym środkiem lub bez niego..
Podczas S. aureus Y E. faecalis trzeba czasem zahamować E. faecalis rozwija się jako bardzo małe, żółte kolonie.
Z drugiej strony, ponieważ podłoże to nie jest autoklawowane, ważne jest, aby ocenić jego sterylność. Dlatego z każdej przygotowanej partii od jednej do dwóch niezaszczepionych płytek należy inkubować w temperaturze 37 ° C przez 24 godziny w warunkach tlenowych..
Oczywiście na talerzu nie oczekuje się żadnego wzrostu.
Ograniczenia
-Gatunki Proteus mogą rozwijać się w tej pożywce, a cechy ich kolonii można pomylić z gatunkami Salmonella lub Shigella. Z tego powodu każdą podejrzaną kolonię należy potwierdzić badaniami biochemicznymi..
-Stosowanie tej pożywki należy koniecznie łączyć z innymi, mniej selektywnymi agarami, ponieważ jeśli poszukiwany mikroorganizm występuje w niskich stężeniach, może nie rozwijać się w tej pożywce..
-Nie przegrzewaj podczas przygotowywania, ponieważ nadmierne ciepło zmienia skład pożywki.
-Kolonie Salmonella powodujące fermentację laktozy mogą pojawiać się nietypowo i mogą pozostać niezauważone.
Bibliografia
- Współtwórcy Wikipedii. Agar dojelitowy Hektoen. Wikipedia, wolna encyklopedia. 13 marca 2019, 23:38 UTC. Dostępne pod adresem: .wikipedia.org / Dostęp 16 marca 2019 r.
- BD Laboratories. BD Hektoen Enteric Agar (HE Agar). 2013 Dostępne na: bd.com
- Britannia Laboratories. Hektoen Enteric Agar. 2015 Dostępne pod adresem: britanialab.com
- Difco Francisco Soria Melguizo Laboratories. Agar Hektoen. Dostępne pod adresem: f-soria.es
- Instrukcja Difco i BBL, Hektoen Enteric Agar. Wydanie 2. Dostępne na: bd.com/europe



Jeszcze bez komentarzy