
Podłoże, przygotowanie i zastosowanie agaru Müeller Hinton
Plik Agar Müellera Hintona Jest to stała, nieselektywna pożywka, na którą składa się napar mięsny, kwaśny pepton kazeinowy, skrobia, agar i woda destylowana. To podłoże umożliwia doskonały wzrost mikroorganizmów większości szybko rosnących bakterii.
Został pierwotnie stworzony przez Johna Howarda Müellera i Jane Hinton, aby wyizolować bakterie wymagające odżywiania, takie jak Neisseria gonorrhoeae Y Neisseria meningitidis. Jednak ze względu na swoje właściwości okazał się idealny do badania wrażliwości na antybiotyki, zapewniając wiarygodne i powtarzalne wyniki..
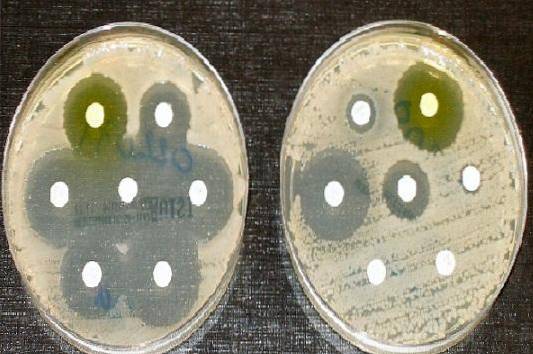
Dlatego agar Müeller Hinton jest pożywką hodowlaną zaakceptowaną przez Clinical and Laboratory Standards Institute (CLSI) oraz European Committee on Antimicrobial Susceptibility Testing, do przeprowadzania testu wrażliwości na środki przeciwdrobnoustrojowe metodą dyfuzji krążkowej Kirby'ego i Bauera..
Indeks artykułów
- 1 Uzasadnienie
- 2 Przygotowanie
- 3 Zastosowania
- 3.1 Technika antybiogramu
- 3.2 Strategiczne umieszczenie krążków na agarze Müellera Hintona
- 4 Przyczyny błędnych wyników
- 5 Ograniczenie
- 6 Kontrola jakości
- 7 Referencje
Podstawa
Będąc nieselektywną pożywką, doskonale nadaje się do wzrostu większości bakterii chorobotwórczych..
Z drugiej strony jego prosty skład sprawia, że substancje łatwo na nim dyfundują, co jest istotną cechą badania wrażliwości metodą dyfuzyjno-krążkową..
Inną jego cechą jest to, że zawiera małą ilość inhibitorów, co pozwala na skuteczną ocenę sulfonamidów, trimetoprimu i tetracyklin..
Należy jednak mieć na uwadze, że medium musi spełniać określone warunki, aby zapewnić jego prawidłowe funkcjonowanie, w tym:
Dostosowanie pH, głębokości agaru i odpowiedniego stężenia tyminy, tymidyny, Ca++, Mg++ i Zn++.
Musisz również wiedzieć, że metodologia jest ustandaryzowana, dlatego wszystkie parametry muszą być spełnione, takie jak:
Stężenie inokulum, stężenie i konserwacja krążków z antybiotykiem, umieszczenie odpowiedniej liczby krążków na agarze, odległość między krążkami, strategiczne rozmieszczenie niektórych antybiotyków, atmosfera, temperatura i czas inkubacji.
Przygotowanie
Odważyć 37 g odwodnionej pożywki Müeller Hinton i rozpuścić w 1 litrze wody destylowanej. Podgrzej pożywkę mieszając, aby ułatwić rozpuszczenie. Gotować przez 1 minutę.
Autoklawuj w celu sterylizacji w 121 ° C przez 15 minut. Podczas wyjmowania z autoklawu kolbę należy umieścić w łaźni wodnej o temperaturze 50 ° C w celu ostygnięcia. Wlać 25 do 30 ml na sterylne szalki Petriego o średnicy 10 cm.
Płytki powinny mieć średnią grubość 4 mm (idealna), dopuszczalny zakres 3-5 mm.
Jeśli pożądane jest przygotowanie agaru z krwią przy użyciu agaru Müellera Hintona jako bazy, przed podaniem na płytki należy wlać 5% jałowej i odwłóknionej krwi jagnięcej..
Końcowe pH pożywki powinno wynosić od 7,2 do 7,4.
Zainwestuj i przechowuj w lodówce do momentu użycia. Przed użyciem odczekać, aż płytka osiągnie temperaturę pokojową.
Kolor przygotowanego podłoża to jasny beż.
Aplikacje
Służy do wykonywania antybiogramu lub testu wrażliwości na antybiotyki dla większości szybko rosnących niewymagających wyborów patogenów.
Jeśli agar jest uzupełniony krwią, służy do przeprowadzenia antybiogramu wymagających mikroorganizmów, takich jak: Streptococcus pneumoniae, Haemophilus sp, Neisseria meningitidis, pośród innych. Był również używany do izolowania Legionella pneumophila.
Technika antybiogramu
Przed wykonaniem antybiogramu należy przygotować roztwór bakteryjny równoważny 1,5 x 10.8 komórki.
W tym celu pobiera się 3 do 4 kolonii czystej kultury i zawiesza w bulionie z tryptykazą sojową lub w bulionie Müellera Hintona, inkubuje przez 2 do 6 godzin, po czym stężenie dostosowuje się jałową solanką, porównując ją ze standardem Mac Farland 0,5 %.
Jeśli są wymagającymi mikroorganizmami, kolonie można zawiesić bezpośrednio do stężenia 0,5% Mac Farland. Następnie płytkę Müeller Hinton wysiewa się wacikiem nasączonym przygotowanym roztworem bakteryjnym..
W tym celu wymazówkę zanurza się w roztworze, a następnie nadmiar płynu usuwa się, naciskając na ścianki probówki. Zaraz potem wacik przesuwa się po całej powierzchni, nie pozostawiając żadnych nietkniętych miejsc, następnie płytkę lekko obraca się i ponownie wysiewa. Operację powtarza się jeszcze 2 razy.
Odstawić na 10 minut, a następnie przymocować krążki z antybiotykiem sterylnymi kleszczami, pozostawiając między nimi 24-milimetrową przerwę. Po umieszczeniu każdego krążka na agarze, lekko dociśnij każdy krążek kleszczami, aby upewnić się, że są dobrze przylegające..
Po zakończeniu procesu płytkę odwraca się i inkubuje w temperaturze 35–37 ° C w aerobiozie przez 16–18 godzin. Jeśli jest to drobnoustrój wymagający, może to uzasadniać mikroaerofilię, a jeśli antybiogram zawiera krążki oksacyliny, należy go odczytać po 24 godzinach..
Linijka służy do pomiaru średnicy każdej aureoli. Wyniki należy zapisać w mm. Następnie uzyskane wartości koreluje się z tabelami punktów podziału opublikowanymi w aktualnym podręczniku CLSI..

Podać jako wrażliwe (S), pośrednie (I) lub odporne (R), w zależności od przypadku.
Antybiotyki dobierane są w zależności od izolowanego mikroorganizmu i rodzaju wywoływanej infekcji.
Czasami należy wziąć pod uwagę strategiczne rozmieszczenie antybiotyków, aby wykazać fenotypowe wzorce oporności.
Strategiczne umieszczenie krążków na agarze Müellera Hintona
W przypadku enterobakterii krążek kwasu klawulanowego należy umieścić na cefalosporynach III i IV generacji. Rozszerzenie w kształcie jajka wskazuje, że szczep jest producentem beta-laktamaz o rozszerzonym spektrum (ESBL). Oznacza to, że pacjent nie powinien być leczony żadnymi cefalosporynami..
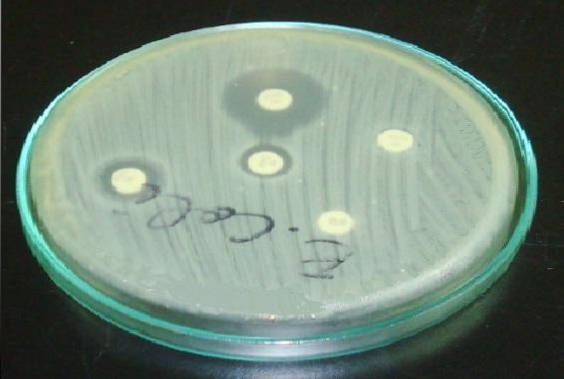
W przypadku Staphylococcus ważne jest, aby umieścić krążek z erytromycyną lub azytromycyną przed krążkiem z klindamycyną (test D).
Oporne halo w erytromycynie i spłaszczenie w halo klindamycyny wskazuje, że szczep posiada indukowaną przez szczep oporność na klindamycynę (ICR). Oznacza to, że leczenie klindamycyną nie będzie skuteczne..
Aby wyszukać indukowalne szczepy AMP C u Enterobacteriaceae i niektórych niefermentujących pałeczek Gram-ujemnych, ceftazydym, cefoksytyna lub piperacylina krążki tazobaktanu są skierowane w stronę krążka z imipenemem w odległości 27 mm.
Spłaszczona halo na jednym z dysków zwróconych w stronę imipenemu wskazuje na obecność indukowalnego AMP C..
W celu poszukiwania konstytutywnego C-AMP, krążek kloksacyliny 500 µg zostaje skierowany do ceftazydymu (30 µg) i cefotaksymu (30 µg) w odległości 25 mm. Poszerzone halo w którejkolwiek z cefalosporyn wskazuje na wynik dodatni.
Krążek kloksacyliny można również zastąpić krążkiem 9 mm z bibuły filtracyjnej Whatman nr 6 impregnowanej kwasem fenyloborowym (400 µg) w odległości 18 mm. Jest interpretowany tak samo jak poprzedni.
Wreszcie, aby zbadać produkcję metalobetalaktamaz, zwłaszcza w Pseudomonas aeruginosa, Używa się krążka impregnowanego 10 µl kwasu etylenodiaminotetraoctowego (EDTA 750 µg) i kwasu tioglikolowego (SMA 300 µg), który jest skierowany w stronę krążków imipenem i meropenem w odległości 15 mm.
Wynik testu jest pozytywny, jeśli występuje poszerzenie halo imipenemu lub meropenemu w kierunku krążka EDTA / SMA. Wynik ten musi zostać potwierdzony zmodyfikowanym testem Hodge'a..
Ta metoda polega na zaszczepieniu szczepu Escherichia coli ATCC 25922 na płycie Müeller Hinton. Krążek imipenemu umieszcza się na środku płytki, a następnie wykonuje się pasmo z krążka w kierunku obrzeża z naciągiem P. aeruginosa podejrzany. Na płytce można przetestować do 4 szczepów.
Wynik testu będzie pozytywny, jeśli wokół rozstępu znajduje się strefa zniekształcenia halo imipenemu.
Przyczyny błędnych wyników
-Źle konserwowane krążki antybiotykowe mogą powodować fałszywą oporność. Na przykład krążek oksacyliny jest bardzo wrażliwy na zmiany temperatury..
-PH podłoża poniżej wskazanego (kwaśne) wytwarza mniejsze halo w aminoglikozydach i makrolidach (ryzyko fałszywej oporności) oraz większe halo w penicylinie, tetracyklinie i nowobiocynie (ryzyko fałszywej wrażliwości).
-Jeśli pH jest wyższe niż wskazane (zasadowe), opisane powyżej efekty są odwracane.
-Pożywki o podwyższonych stężeniach tyminy i tymidyny mają wpływ poprzez znaczne zmniejszenie halo hamowania sulfonamidów i trimetoprimu..
-Wysokie stężenia wapnia i magnezu powodują fałszywą oporność aminoglikozydów, polimyksyny B i tetracyklin na szczepy Pseudomonas aeruginosa.
-Niskie stężenia wapnia i magnezu powodują fałszywą wrażliwość aminoglikozydów, polimyksyny B i tetracyklin na szczepy Pseudomonas aeruginosa.
-Obecność cynku wpływa na wyniki krążków karbapenemowych (imipenem, meropenem i ertapenem).
-Grubość nośnika poniżej 3 mm spowoduje fałszywe wyniki czułości, podczas gdy grubość powyżej 5 spowoduje fałszywą oporność.
-Mobilizacja dysków w antybiogramie spowoduje zdeformowane aureole, ponieważ uwolnienie antybiotyków jest natychmiastowe.
- Bardzo słabe inokulum wpływa na wyniki, ponieważ nie będzie równomiernego lub zlewnego wzrostu w agarze, co jest warunkiem koniecznym do pomiaru aureoli zahamowania, oprócz tego, że aureole mogą dawać większe niż normalnie.
-Przeładowane inokulum może dawać mniejsze aureole niż normalne.
-Nieprzestrzeganie odległości między płytami powoduje, że jedna aureola nakłada się na drugą i nie można ich poprawnie odczytać.
-Inkubuj z COdwa zwiększa rozmiar aureoli krążków tetracykliny i metycyliny.
-Inkubacja w temperaturach poniżej 35 ° C daje większe halo.
-Dodatek krwi zmniejsza rozmiar halo sulfonamidu.
Ograniczenie
Wrażliwość antybiotyku wykazana w antybiogramie na drobnoustrój (in vitro) nie gwarantuje, że zadziała in vivo.
QA
Aby wiedzieć, czy pożywka zawiera odpowiednią ilość tyminy, należy wyhodować szczep Enterococcus faecalis ATCC 29212 i zbadać wrażliwość na trimetoprim sulfametoksazol (SXT), musi dać halo równe lub> 20 mm, aby było zadowalające.
Bibliografia
- "Agar Müller-Hinton." Wikipedia, wolna encyklopedia. 16 listopada 2018 r., 12:23 UTC. 27 stycznia 2019, 04:22
- Forbes B, Sahm D, Weissfeld A. (2009). Diagnoza mikrobiologiczna Bailey & Scott. 12 ed. Od redakcji Panamericana S.A. Argentyna.
- Cona E. Warunki dobrego badania wrażliwości za pomocą testu dyfuzyjnego na agarze. Rev Chil Infect, 2002; 19 (2): 77–81
- Laboratorium Difco Francisco Soria Melguizo. Agar Müeller Hinton z 5% krwi baraniej. 2009. Dostępne pod adresem: http://f-soria.es
- Laboratorium BD Müeller Hinton II Agar Laboratory. Dostępne pod adresem: .bd.com
- Britannia Laboratories. Agar Müellera Hintona. 2015 Dostępne pod adresem: britanialab.com
- Koneman E, Allen S, Janda W, Schreckenberger P, Winn W. (2004). Diagnoza mikrobiologiczna. 5th ed. Od redakcji Panamericana S.A. Argentyna.
- Martínez-Rojas D.Betalaktamazy typu AmpC: Ogólne informacje i metody wykrywania fenotypu. Rev. Soc. Ven. Microbiol. 2009; 29 (2): 78–83. Dostępne pod adresem: scielo.org.
- Perozo A, Castellano M, Ling E, Arraiz N. Fenotypowe wykrywanie metalobetalaktamaz w izolatach klinicznych Pseudomonas aeruginosa. Kasmera, 2012; 40 (2): 113-121. Dostępne pod adresem: scielo.org.



Jeszcze bez komentarzy