
Struktura, właściwości, zastosowania i zagrożenia alkoholu izoamylowego
Plik alkohol izoamylowy jest związkiem organicznym, którego wzór to (CH3)dwaCHCHdwaCHdwaO. Pod względem chemicznym jest to rozgałęziony alkohol pierwszorzędowy i stanowi jeden z izomerów pentanolu, zwanych alkoholami amylowymi (C5H.12LUB).
Podobnie jak wiele alkoholi o niskiej masie cząsteczkowej, w temperaturze pokojowej jest bezbarwną cieczą. Pozwala to i ułatwia jego użycie jako rozpuszczalnika do różnych zastosowań; tym bardziej, że po utylizacji nie wywiera zbyt wielu negatywnych skutków dla ekosystemu.
Chociaż jest to materiał pośredni w syntezie octanu amylu do produkcji sztucznych aromatów bananowych, jego własny zapach jest nieprzyjemny i podobny do zapachu gruszek..
Oprócz tego, że służy jako rozpuszczalnik dla wielu substancji biologicznych i jako półprodukt w syntezie innych octanów, zmniejsza napięcie powierzchniowe niektórych formulacji przemysłowych, zapobiegając tworzeniu się pianek. Dlatego jest stosowany w systemach mikroemulsyfikowanych.
Jeśli chodzi o jego naturalne pochodzenie, alkohol izoamylowy został znaleziony w feromonach szerszeni oraz w czarnych truflach, gatunku grzybów występujących w południowo-wschodniej Europie..
Indeks artykułów
- 1 Struktura alkoholu izoamylowego
- 1.1 Oddziaływania międzycząsteczkowe
- 2 Właściwości
- 2.1 Wygląd fizyczny
- 2.2 Zapach i smak
- 2.3 Masa molowa
- 2.4 Gęstość
- 2.5 Gęstość par
- 2.6 Prężność par
- 2.7 Temperatura wrzenia
- 2.8 Temperatura topnienia
- 2.9 Temperatura zapłonu
- 2.10 Temperatura samozapłonu
- 2.11 Rozpuszczalność
- 2.12 Lepkość
- 2.13 Napięcie powierzchniowe
- 2.14 Współczynnik załamania światła
- 2.15 Pojemność cieplna
- 3 Zastosowania
- 3.1 Surowiec
- 3.2 Zapachy
- 3.3 Środek przeciwpieniący
- 3.4 Ekstrakcje
- 4 Ryzyka
- 4.1 Przechowywanie i reaktywność
- 4.2 Zdrowie
- 5 Referencje
Struktura alkoholu izoamylowego
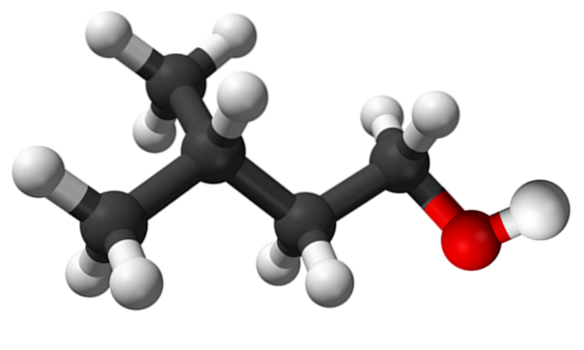
Górny obraz przedstawia cząsteczkę alkoholu izoamylowego reprezentowaną przez model sfer i słupków. Po prawej stronie czerwonawa sfera odpowiada atomowi tlenu z grupy OH, charakterystycznej dla wszystkich alkoholi; podczas gdy po lewej jest szkielet węglowy z grupą metylową, CH3, struktura rozgałęziona.
Z molekularnego punktu widzenia związek ten jest dynamiczny, ponieważ zawiera atomy z hybrydyzacjami sp3, ułatwianie obracania linków; o ile nie powoduje zaćmienia OH i CH3.
Warto również wspomnieć o jego amfifilowej charakterystyce: posiada apolarny lub hydrofobowy koniec, składający się z łańcucha (CH3)dwaCHCHdwaCHdwa-, i polarną lub hydrofilową głowę, grupę OH. Ta definicja dwóch określonych obszarów o różnych polaryzacjach czyni ten alkohol środkiem powierzchniowo czynnym; stąd jego zastosowanie do mikroemulsji.
Oddziaływania międzycząsteczkowe
Biorąc pod uwagę obecność grupy OH, cząsteczka alkoholu izoamylowego wykazuje trwały moment dipolowy. W konsekwencji siły dipolowo-dipolowe potrafią związać swoje cząsteczki, odpowiedzialne za fizyczne i mierzalne właściwości cieczy oraz jej zapach..
Chociaż rozgałęzienie głównych łańcuchów zmniejsza efektywne interakcje między cząsteczkami, wiązania wodorowe w tym alkoholu kompensują ten spadek, powodując wrzenie cieczy w 131 ° C, temperaturze powyżej temperatury wrzenia wody..
Nie to samo dzieje się z ciałem stałym lub „lodem”, który topi się w temperaturze -117 ° C, co wskazuje, że interakcje międzycząsteczkowe nie są wystarczająco silne, aby utrzymać porządek w cząsteczkach; zwłaszcza jeśli grupa CH3 rozgałęziająca główny łańcuch zapobiega lepszemu kontaktowi między cząsteczkami.
Nieruchomości
Wygląd fizyczny
Bezbarwna ciecz.
Zapach i smak
Wydziela nieprzyjemny zapach gruszki i ma ostry smak.
Masa cząsteczkowa
88,148 g / mol.
Gęstość
0,8104 g / ml w temperaturze 20 ° C Dlatego jest mniej gęsty niż woda.
Gęstość pary
Jest 3,04 razy gęstsza od powietrza.
Ciśnienie pary
2,37 mmHg w 25 ° C.
Temperatura wrzenia
131,1 ° C.
Temperatura topnienia
-117,2 ° C.
punkt zapłonu
43 ° C (zamknięty tygiel).
Temperatura samozapłonu
340 ° C.
Rozpuszczalność
Jest względnie rozpuszczalny w wodzie: 28 g / l. Dzieje się tak, ponieważ wysoce polarne cząsteczki w wodzie nie mają szczególnego powinowactwa do łańcucha węglowego alkoholu izoamylowego. Gdyby były zmieszane, zaobserwowano by dwie fazy: niższą, odpowiadającą wodzie i wyższą, z alkoholem izoamylowym..
W przeciwieństwie do tego jest znacznie lepiej rozpuszczalny w mniej polarnych rozpuszczalnikach, takich jak: aceton, eter dietylowy, chloroform, etanol lub lodowaty kwas octowy; a nawet w eterze naftowym.
Lepkość
3738 cP w 25 ° C.
Napięcie powierzchniowe
24,77 dyn / cm w 15 ° C.
Współczynnik załamania światła
1,4075 w 20 ° C.
Pojemność cieplna
2382 kJ / gK.
Aplikacje
Surowiec
Inne estry, tiofen i leki, takie jak azotyn amylu, Validol (izowalerianian mentylu), Bromisoval (bromowalerylo-mocznik), Corvalol (środek uspokajający waleriany) i Barbamil (amobarbital) mogą być syntetyzowane z alkoholu izoamylowego..
Zapachy
Oprócz wykorzystania do syntezy octanu amylu, który ma aromat bananowy, uzyskuje się z niego również inne zapachy owocowe, takie jak morela, pomarańcze, śliwka, wiśnia i słód. Dlatego jest niezbędnym alkoholem przy produkcji wielu produktów jadalnych czy kosmetycznych..
Środek przeciwpieniący
Zmniejszając napięcie powierzchniowe, sprzyja jego zastosowaniu w układach mikroemulgowanych. Praktycznie unika przyspieszonego tworzenia się pęcherzyków, zmniejszając je aż do pęknięcia.
Pomaga również lepiej określić granicę rozdziału między fazą wodną i organiczną podczas ekstrakcji; na przykład do mieszaniny ekstrakcyjnej dodaje się fenol-chloroform w stosunku 25: 24: 1. Ta technika jest przeznaczona do ekstrakcji DNA.
Ekstrakcje
Alkohol izoamylowy umożliwia również ekstrakcję tłuszczów lub olejów z różnych próbek, na przykład z mleka. Rozpuszcza również parafinę, tusze, gumy, lakiery i estry celulozy.
Kontynuując ekstrakcje, można otrzymać kwas fosforowy z roztworów azotanowych minerałów fosforanu żelaza..
Ryzyka
Przechowywanie i reaktywność
Jak każda ciecz wydzielająca zapachy, może stanowić nieuchronne zagrożenie pożarowe, jeśli miejsce, w którym jest przechowywany, podniesie zbyt wysoką temperaturę, a tym bardziej, jeśli jest już źródło ciepła..
W tych warunkach działa po prostu jak paliwo, podsycając płomienie, a nawet eksplodując pojemnik. Podczas spalania uwalnia opary, które mogą wpływać na zdrowie i powodować uduszenie.
Innym powodem zapalenia się alkoholu izoamylowego jest jego mieszanie lub reagowanie z takimi substancjami jak: nadchlorany, nadtlenki, brom, fluor, wodorki metali, mocne kwasy, aminy alifatyczne itp..
Zdrowie
W kontakcie ze skórą może ją podrażniać i wysuszać. Objawy są jednak cięższe, jeśli wdychane są zbyt długo (kaszel, oparzenia nosa, gardła i płuc) lub po połknięciu (ból głowy, nudności, biegunka, wymioty, zawroty głowy i utrata przytomności).
I wreszcie, gdy dostanie się do oczu, podrażnia je, a nawet może nieodwracalnie uszkodzić. Na szczęście jego zapach „alkoholowej gruszki” pozwala na wykrycie go w przypadku wycieku lub rozlania; ponadto jest to związek, z którym należy obchodzić się z szacunkiem.
Bibliografia
- Morrison, R. T. and Boyd, R, N. (1987). Chemia organiczna. Wydanie 5. Od redakcji Addison-Wesley Interamericana.
- Carey F. (2008). Chemia organiczna. (Wydanie szóste). Mc Graw Hill.
- Graham Solomons T.W., Craig B. Fryhle. (2011). Chemia organiczna. Aminy. (Wydanie 10.). Wiley plus.
- Wikipedia. (2019). Alkohol izoamylowy. Odzyskane z: en.wikipedia.org
- Narodowe Centrum Informacji Biotechnologicznej. (2019). Alkohol izoamylowy. Baza danych PubChem. CID = 31260. Odzyskany z: pubchem.ncbi.nlm.nih.gov
- Zhang Yu i Muhammed Mamoun. (17 września 2008). Ekstrakcja kwasu fosforowego z roztworów azotanów alkoholem izoamylowym. Ekstrakcja rozpuszczalnikowa i wymiana jonowa, tom 6, 1988 - wydanie 6. doi.org/10.1080/07366298808917973
- Departament Zdrowia stanu New Jersey. (2008). Alkohol izoamylowy. [PDF]. Odzyskany z: nj.gov
- Kat Chem. (2019). Alkohol izoamylowy. Odzyskany z: kat-chem.hu
- Chemoxy International Ltd. (s.f.). Alkohol izoamylowy. Źródło: chemoxy.com


Jeszcze bez komentarzy