
Budowa, właściwości, rodzaje, zastosowania, przykłady
Plik aminy są to związki organiczne pochodzące z amoniaku. W nich są wiązania kowalencyjne między węglem a azotem. Naturalnie cząsteczka azotu jest kinetycznie obojętna; ale dzięki biologicznemu utrwaleniu przekształca się w amoniak, który z kolei ulega kolejnym reakcjom alkilowania.
Kiedy amoniak jest „alkilowany”, zastępuje jeden, dwa lub trzy z trzech atomów wodoru atomami węgla. Te węgle mogą pochodzić z grupy alkilowej (R) lub arylowej (Ar). Tak więc istnieją aminy alifatyczne (liniowe lub rozgałęzione) i aromatyczne.

Ogólny wzór amin alifatycznych przedstawiono powyżej. Ten wzór można zastosować do amin aromatycznych, biorąc pod uwagę, że R może być również grupą arylową Ar. Zwróć uwagę na podobieństwo między aminą i amoniakiem, NH3. Praktycznie litera H została zastąpiona łańcuchem bocznym R..
Jeśli R składa się z łańcuchów alifatycznych, masz tak zwaną alkiloaminę; podczas gdy jeśli R ma charakter aromatyczny, to aryloamina. Spośród aryloamin najważniejsza jest alanina: grupa aminowa -NHdwa, związane z pierścieniem benzenowym.
Gdy w strukturze molekularnej znajdują się grupy utlenione, takie jak OH i COOH, związek nie jest już nazywany aminą. W takim przypadku aminę uważa się za podstawnik: grupę aminową. Na przykład dzieje się tak w aminokwasach, a także w innych biomolekułach o ogromnym znaczeniu dla życia..
Ponieważ azot znajduje się w wielu niezbędnych do życia związkach, uznano je za niezbędne do życia aminy; tj. „witaminy”. Jednak wiele witamin nie jest nawet aminami, a ponadto nie wszystkie są niezbędne do życia. Nie neguje to jednak jego wielkiego znaczenia dla organizmów żywych..
Aminy są silniejszymi zasadami organicznymi niż sam amoniak. Są łatwo ekstrahowane z materii roślinnej i generalnie mają silne interakcje z macierzą neuronalną organizmów; stąd wiele leków i leków składa się z amin o złożonej strukturze i podstawnikach.
Indeks artykułów
- 1 Struktura
- 2 Właściwości amin
- 2.1 Biegunowość
- 2.2 Charakterystyka fizyczna
- 2.3 Rozpuszczalność w wodzie
- 2.4 Podstawowość
- 3 rodzaje (podstawowy, drugorzędny, trzeciorzędny)
- 4 Szkolenie
- 4.1 Alkilowanie amoniaku
- 4.2 Katalityczne uwodornienie
- 5 Nazewnictwo
- 6 zastosowań
- 6.1 Barwniki
- 6.2 Narkotyki i narkotyki
- 6.3 Oczyszczanie gazów
- 6.4 Chemia rolnicza
- 6.5 Produkcja żywic
- 6.6 Składniki odżywcze dla zwierząt
- 6.7 Przemysł gumowy
- 6.8 Rozpuszczalniki
- 7 przykładów
- 7.1 Kokaina
- 7.2 Nikotyna
- 7.3 Morfina
- 7.4 Serotonina
- 8 Odniesienia
Struktura
Jaka jest jego struktura? Chociaż zmienia się w zależności od natury R, otoczenie elektronowe atomu azotu jest takie samo dla wszystkich z nich: tetraedryczne. Ale ponieważ na atomie azotu (ˇ) znajduje się para niewspółdzielonych elektronów, geometria molekularna staje się piramidalna. Tak jest w przypadku amoniaku i amin.
Aminy można przedstawić za pomocą czworościanu, podobnie jak związki węgla. Zatem NH3 i CH4 narysowane są jako czworościany, gdzie para (··) znajduje się na jednym z wierzchołków nad azotem.
Obie cząsteczki są achiralne; jednak zaczynają prezentować chiralność, gdy ich H są zastępowane przez R. Amina RdwaNH jest achiralny, jeśli dwa R są różne. Brakuje jednak żadnej konfiguracji, aby odróżnić jeden enancjomer od drugiego (jak ma to miejsce w przypadku chiralnych centrów węgla).
Dzieje się tak, ponieważ enancjomery:
RdwaN-H | H-NRdwa
są wymieniane w takim tempie, że żaden z nich nie może się odizolować; dlatego też struktury amin są uważane za achiralne, mimo że wszystkie podstawniki na atomie azotu są różne.
Właściwości amin
Biegunowość
Aminy są związkami polarnymi, ponieważ grupa aminowa NHdwa, posiadając elektroujemny atom azotu, przyczynia się do momentu dipolowego cząsteczki. Należy zauważyć, że azot ma zdolność przekazywania wiązań wodorowych, co powoduje, że aminy mają ogólnie wysoką temperaturę wrzenia i topnienia..
Jednak gdy porównuje się tę właściwość z właściwościami związków utlenionych, takich jak alkohole i kwasy karboksylowe, dają one mniejsze wartości..
Na przykład temperatura wrzenia etyloaminy, CH3CHdwaNHdwa (16,6 ° C) jest niższa niż w przypadku etanolu, CH3CHdwaOH (78ºC).
W ten sposób wykazano, że wiązania wodorowe O-H są silniejsze niż wiązania N-H, mimo że amina może tworzyć więcej niż jeden mostek. To porównanie jest ważne tylko wtedy, gdy R ma taką samą masę cząsteczkową dla dwóch związków (CH3CHdwa-). Z drugiej strony etan wrze w temperaturze -89ºC, CH3CH3, będąc gazem w temperaturze pokojowej.
Ponieważ amina ma mniej wodoru, tworzy mniej wiązań wodorowych, a jej temperatura wrzenia jest obniżona. Widać to porównując temperaturę wrzenia dimetyloaminy (CH3)dwaNH (7 ° C), razem z etyloaminą (16,6 ° C).
Charakterystyka fizyczna
W świecie chemii, kiedy mówisz o aminie, dochodzi do mimowolnego trzymania się za nos. Dzieje się tak, ponieważ generalnie mają one nieprzyjemne zapachy, z których niektóre przypominają zapach zgniłej ryby..
Ponadto ciekłe aminy mają zwykle żółtawe odcienie, co zwiększa ich wizualną nieufność..
Rozpuszczalność w wodzie
Aminy są zwykle nierozpuszczalne w wodzie, ponieważ pomimo tego, że mogą tworzyć wiązania wodorowe z HdwaLub jego główny składnik organiczny jest hydrofobowy. Im większe lub dłuższe grupy R, tym niższa ich rozpuszczalność w wodzie..
Jednak gdy w pożywce znajduje się kwas, rozpuszczalność zwiększa się przez tworzenie tak zwanych soli aminowych. W nich azot ma dodatni ładunek cząstkowy, który elektrostatycznie przyciąga anionową lub sprzężoną zasadę kwasu..
Na przykład, w rozcieńczonym roztworze HCl, amina RNHdwa reaguje w następujący sposób:
RNHdwa + HC1 => RNH3+Cl- (podstawowa sól aminy)
RNHdwa Był nierozpuszczalny (lub słabo rozpuszczalny) w wodzie, aw obecności kwasu tworzy sól, której solwatacja jonów sprzyja jej rozpuszczalności.
Dlaczego to się zdarza? Odpowiedź tkwi w jednej z głównych właściwości amin: są one polarne i zasadowe. Ponieważ są one zasadowe, będą reagować z kwasami wystarczająco silnymi, aby je protonować, zgodnie z definicją Brönsteda-Lowry'ego..
Zasadowość
Aminy są silniejszymi zasadami organicznymi niż amoniak. Im wyższa gęstość elektronów wokół atomu azotu, tym bardziej będzie on podstawowy; to znaczy, będzie szybciej deprotonować kwasy w środowisku. Jeśli amina jest bardzo zasadowa, może nawet ukraść proton z alkoholi.
Grupy R wnoszą do azotu gęstość elektronów poprzez efekt indukcyjny; ponieważ nie możemy zapominać, że jest to jeden z najbardziej elektroujemnych istniejących atomów. Jeśli te grupy są bardzo długie lub nieporęczne, efekt indukcyjny będzie większy, co również zwiększy obszar ujemny wokół pary elektronów (··).
Powoduje to szybsze przyjęcie jonu H przez (··)+. Jednakże, jeśli R są bardzo obszerne, zasadowość spada z powodu efektu sterycznego. Dlaczego? Z tego prostego powodu, że H+ musi przekroczyć konfigurację atomów, zanim dotrze do azotu.
Innym sposobem rozumowania zasadowości aminy jest stabilizowanie jej soli aminowej. Teraz ten, który zmniejsza się przez efekt indukcyjny, może zmniejszyć dodatni ładunek N+, będzie to bardziej podstawowa amina. Powody są takie same, jak właśnie wyjaśniono.
Alkiloaminy a aryloaminy
Alkiloaminy są znacznie bardziej zasadowe niż aryloaminy. Dlaczego? Aby to po prostu zrozumieć, pokazano strukturę aniliny:
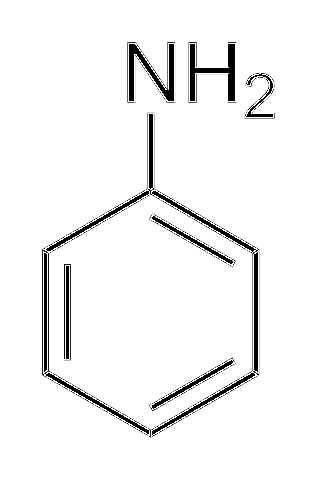
Powyżej, w grupie aminowej, znajduje się para elektronów (ˇˇ). Ta para „podróżuje” wewnątrz pierścienia w pozycjach orto i para względem NHdwa. Oznacza to, że dwa górne wierzchołki i przeciwnie do NHdwa są naładowane ujemnie, a atom azotu dodatnio.
Ponieważ azot jest naładowany dodatnio, +N, odpycha jon H.+. A jeśli to nie wystarczy, para elektronów jest zdelokalizowana w pierścieniu aromatycznym, co czyni ją mniej dostępną dla kwasów deprotonowych..
Zasadowość aniliny może wzrosnąć, jeśli grupy lub atomy, które nadają jej gęstość elektronową, są połączone z pierścieniem, konkurując z parą (· ·) i zmuszając ją do zlokalizowania z większym prawdopodobieństwem na atomie azotu, gotowym do działania jako baza.
Rodzaje (podstawowe, drugorzędne, trzeciorzędne)

Chociaż nie zostało to formalnie przedstawione, pośrednio odniesiono się do pierwszorzędowych, drugorzędowych i trzeciorzędowych amin (górne zdjęcie, od lewej do prawej).
Aminy pierwszorzędowe (RNHdwa) są monopodstawione; drugorzędne (R.dwaNH) są dipodstawione dwiema grupami R-alkilowymi lub arylowymi; i trzeciorzędnych (R.3N) są trójpodstawione i nie zawierają wodoru.
Wszystkie istniejące aminy pochodzą z tych trzech typów, więc ich różnorodność i interakcje z macierzą biologiczną i neuronalną są ogromne.
Ogólnie można oczekiwać, że aminy trzeciorzędowe będą najbardziej podstawowymi; Jednak takiego stwierdzenia nie można uczynić bez znajomości struktur R..
Trening
Alkilacja amoniaku
Na początku wspomniano, że aminy wywodzą się z amoniaku; dlatego najprostszym sposobem ich wytworzenia jest ich alkilowanie. Aby to zrobić, nadmiar amoniaku poddaje się reakcji z halogenkiem alkilu, a następnie dodaje się zasadę w celu zneutralizowania soli aminowej:
NH3 + RX => RNH3+X- => RNHdwa
Należy zauważyć, że te etapy prowadzą do pierwszorzędowej aminy. Mogą również powstawać aminy drugorzędowe, a nawet trzeciorzędowe, więc wydajność pojedynczego produktu spada.
Niektóre metody treningowe, takie jak synteza Gabriela, pozwalają na otrzymanie amin pierwszorzędowych, dzięki czemu nie powstają inne niepożądane produkty.
Również ketony i aldehydy można redukować w obecności amoniaku i pierwszorzędowych amin, dając początek drugorzędowym i trzeciorzędowym aminom..
Katalityczne uwodornienie
Związki nitrowe można redukować w obecności wodoru i katalizatora do odpowiadających im amin.
ArNOdwa => ArNHdwa
Nitryle, RC≡N i amidy, RCONRdwa, są również redukowane do odpowiednio pierwszorzędowych i trzeciorzędowych amin.
Nomenklatura
Jak nazywa się aminy? W większości są one nazywane na podstawie R, grupy alkilowej lub arylowej. Do nazwy R, pochodzącej od jego alkanu, na końcu dodaje się słowo „amina”.
Zatem CH3CHdwaCHdwaNHdwa to propyloamina. Z drugiej strony, można go nazwać biorąc pod uwagę tylko alkan, a nie grupę R: propanoaminę.
Pierwszy sposób nazywania ich jest zdecydowanie najbardziej znanym i najczęściej używanym.
Gdy są dwie grupy NHdwa, nazwano alkan i wymieniono pozycje grup aminowych. Tak więc HdwaNCHdwaCHdwaCHdwaCHdwaNHdwa nazywa się: 1,4-butanodiamina.
Jeśli istnieją grupy utlenione, takie jak OH, powinno mieć pierwszeństwo przed NHdwa, który jest nazwany jako podstawnik. Na przykład HOCHdwaCHdwaCHdwaNHdwa Nazywa się: 3-aminopropanol.
A w przypadku amin drugorzędowych i trzeciorzędowych litery N są używane do wskazania grup R. Najdłuższy łańcuch pozostanie z nazwą związku. Tak więc ch3NHCHdwaCH3 Nazywa się: N-Methylethylamine.
Aplikacje
Barwniki
Pierwszorzędowe aminy aromatyczne mogą służyć jako materiał wyjściowy do syntezy barwników azowych. Początkowo aminy reagują tworząc sole diazoniowe, które tworzą związki azowe poprzez sprzężenie azowe (lub sprzężenie diazowe)..
Te ze względu na intensywne zabarwienie wykorzystywane są w przemyśle tekstylnym jako materiał barwiący; na przykład: oranż metylowy, bezpośredni brąz 138, żółcień pomarańczowa FCF i ponceau.
Narkotyki i narkotyki
Wiele leków działa z agonistami i antagonistami naturalnych neuroprzekaźników aminowych. Przykłady:
-Chlorofeniramina jest lekiem przeciwhistaminowym stosowanym w kontroli procesów alergicznych spowodowanych spożyciem niektórych pokarmów, katarem siennym, ukąszeniami owadów itp..
-Chlorpromazyna jest środkiem uspokajającym, a nie nasennym. Łagodzi niepokój, a nawet jest stosowany w leczeniu niektórych zaburzeń psychicznych.
-Efedryna i fenylefedryna są stosowane jako leki udrażniające drogi oddechowe.
-Amitryptylina i imipramina to trzeciorzędowe aminy stosowane w leczeniu depresji. Ze względu na swoją budowę zaliczane są do trójpierścieniowych leków przeciwdepresyjnych..
-Opioidowe leki przeciwbólowe, takie jak morfina, kodelina i heroina, są aminami trzeciorzędowymi.
Oczyszczanie gazów
Do eliminacji dwutlenku węgla (CO) używa się kilku amin, w tym diglikolaminy (DGA) i dietanoloaminy (DEA).dwa) i siarkowodór (H.dwaS) występuje w gazie ziemnym i rafineriach.
Chemia rolnicza
Metyloaminy są związkami pośrednimi w syntezie chemikaliów stosowanych w rolnictwie jako herbicydy, fungicydy, insektycydy i biocydy.
Produkcja żywicy
Metyloaminy są wykorzystywane przy produkcji żywic jonowymiennych, które znajdują zastosowanie w dejonizacji wody.
Odżywki dla zwierząt
Trimetyloamina (TMA) jest wykorzystywana przede wszystkim do produkcji chlorku choliny, suplementu witaminy B stosowanego w żywieniu kurczaków, indyków i świń..
Przemysł gumowy
Oleinian dimetyloaminy (DMA) jest emulgatorem do stosowania przy produkcji kauczuku syntetycznego. DMA jest stosowany bezpośrednio jako modyfikator polimeryzacji w fazie gazowej butadienu oraz jako stabilizator lateksu kauczuku naturalnego w miejsce amoniaku
Rozpuszczalniki
Dimetyloamina (DMA) i monometyloamina (MMA) są używane do syntezy aprotycznych polarnych rozpuszczalników dimetyloformamidu (DMF), dimetyloacetamidu (DMAc) i n-metylopirolidonu (NMP).
Zastosowania DMF obejmują: powlekanie uretanu, rozpuszczalnik przędzy akrylowej, rozpuszczalniki reakcyjne i rozpuszczalniki ekstrakcyjne.
DMAc jest używany do produkcji barwników i rozpuszczalników do przędzy. Wreszcie NMP jest stosowany w rafinacji olejów smarowych, środków do usuwania farby i powłok emaliowanych..
Przykłady
Kokaina
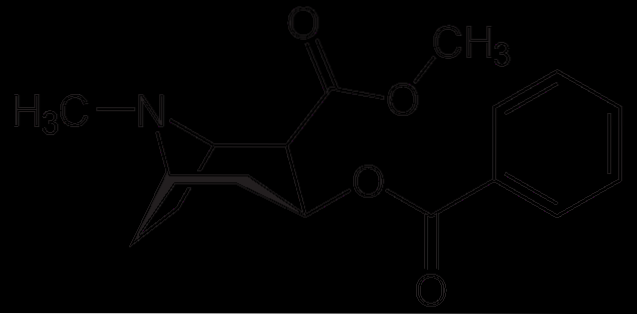
Kokaina jest stosowana jako środek miejscowo znieczulający w niektórych rodzajach operacji oczu, uszu i gardła. Jak widać, jest to trzeciorzędowa amina.
Nikotyna

Nikotyna jest głównym czynnikiem powodującym uzależnienie od tytoniu, a chemicznie jest aminą trzeciorzędową. Nikotyna zawarta w dymie tytoniowym jest szybko wchłaniana i silnie toksyczna.
Morfina
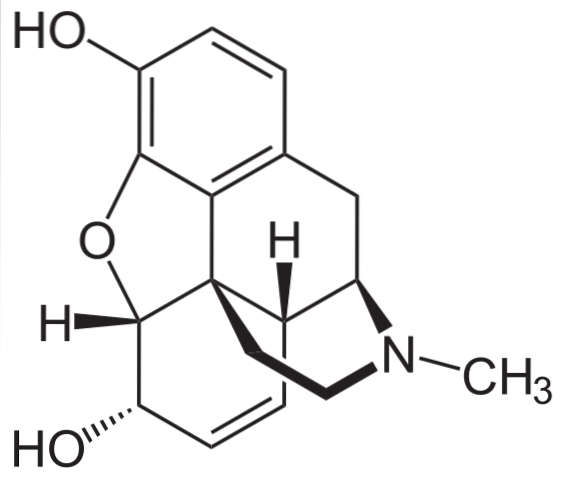
Jest to jeden z najskuteczniejszych środków przeciwbólowych, łagodzących ból, zwłaszcza raka. To znowu trzeciorzędowa amina.
Serotonina

Serotonina jest aminowym neuroprzekaźnikiem. U pacjentów z depresją stężenie głównego metabolitu serotoniny jest zmniejszone. W przeciwieństwie do innych amin, ta jest pierwszorzędowa.
Bibliografia
- Graham Solomons T.W., Craig B. Fryhle. (2011). Chemia organiczna. Aminy. (10th wydanie.). Wiley plus.
- Carey F. (2008). Chemia organiczna. (Wydanie szóste). Mc Graw Hill.
- Morrison i Boyd. (1987). Chemia organiczna. (Piąta edycja). Addison-Wesley Iberoamericana.
- The Chemours Company. (2018). Metyloaminy: zastosowania i zastosowania. Źródło: chemours.com
- Badania rynku dotyczące przejrzystości. (s.f.). Aminy: ważne fakty i zastosowania. Odzyskany z: transparencymarketresearch.com
- Wikipedia. (2019). Amina. Odzyskane z: en.wikipedia.org
- Ganong, W. F. (2003). Fizjologia medyczna. Wydanie XIX. Od redakcji The Modern Manual.



Jeszcze bez komentarzy