
Charakterystyka, typy, funkcje, badania autofagii

Plik autofagia jest to wewnątrzkomórkowy system degradacji, który zachodzi w sposób konserwatywny w lizosomach wszystkich komórek eukariotycznych (i wakuolach drożdży). Słowo to jest ogólnie używane w odniesieniu do degradacji składników cytozolu lub „części” komórki, które są „przestarzałe” lub przestały działać prawidłowo..
Termin autofagia został ukuty w 1963 roku na Uniwersytecie Rockefellera przez de Duve, który również obserwował i opisywał procesy endocytozy komórkowej. Dosłownie słowo autofagia oznacza „skonsumować siebie”, chociaż niektórzy autorzy określają to jako „kanibalizm własny”.
System ten różni się od degradacji za pośrednictwem proteasomów tym, że autofagia jest zdolna do usuwania całych wewnątrzkomórkowych organelli i dużych kompleksów białkowych lub agregatów w sposób nieselektywny..
Pomimo tej nieselektywnej fagocytozy, różne badania wykazały, że autofagia ma liczne implikacje fizjologiczne i patologiczne. Ponieważ jest aktywowany w okresach adaptacji do głodu, podczas rozwoju, w celu eliminacji inwazyjnych mikroorganizmów, podczas programowanej śmierci komórki, w celu eliminacji nowotworów, prezentacji antygenów itp..
Indeks artykułów
- 1 Funkcje
- 1.1 Indukcja autofagii
- 2 rodzaje
- 2.1 Makroautofagia
- 2.2 Mikroautofagia
- 2.3 Autofagia zależna od opiekuna
- 3 Funkcje
- 3.1 Role w zdrowiu i rozwoju
- 4 Badania Yoshinori Ohsumi
- 5 Referencje
Charakterystyka
Autofagia, jak omówiono, jest procesem, w którym pośredniczy cytoplazmatyczne organelle zwane lizosomami..
Proces „autofagii” rozpoczyna się od hermetyzacji organelli, które zostaną zdegradowane przez podwójną membranę, tworząc błoniaste ciało zwane autofagosomem. Błona autofagosomu następnie łączy się z błoną lizosomalną lub z późnym endosomem.
Każdy z tych etapów między sekwestracją, degradacją i uwolnieniem aminokwasów lub innych składników do recyklingu spełnia różne funkcje w różnych kontekstach komórkowych, czyniąc autofagię wysoce wielofunkcyjnym systemem..
Autofagia jest procesem dość kontrolowanym, ponieważ tylko zaznaczone składniki komórkowe są kierowane na ten szlak degradacji, a znakowanie zwykle występuje podczas procesów przebudowy komórek..
Na przykład, gdy komórka wątroby ustanawia odpowiedź detoksykacyjną w odpowiedzi na leki rozpuszczalne w tłuszczach, jej gładka siateczka endoplazmatyczna znacznie się proliferuje, a gdy bodziec generowany przez lek zmniejsza się, nadmiar gładkiej retikulum endoplazmatycznego jest usuwany z przestrzeni cytozolowej na drodze autofagii..
Indukcja autofagii
Jednym ze zdarzeń, które najczęściej wyzwalają procesy autofagiczne, jest głód..
W zależności od rozpatrywanego organizmu różne rodzaje niezbędnych składników odżywczych mogą wywołać ten system „recyklingu”. Na przykład w drożdżach, chociaż brak węgla w niektórych aminokwasach i kwasach nukleinowych może wywoływać autofagię, brak azotu jest najbardziej skutecznym bodźcem, który jest również ważny dla komórek roślinnych..
Chociaż nie zostało to w pełni zrozumiane, komórki mają specjalne „czujniki”, które pozwalają określić, kiedy składnik odżywczy lub niezbędny aminokwas jest w bardzo złym stanie, a tym samym wywołać cały proces recyklingu poprzez lizosomy.
U ssaków niektóre hormony uczestniczą w regulacji (dodatniej lub ujemnej) autofagii w komórkach należących do niektórych narządów, takich jak insulina, niektóre czynniki wzrostu czy interleukiny itp..
Rodzaje
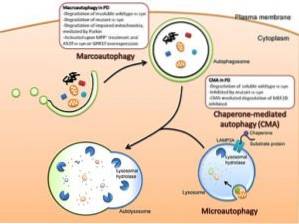
Istnieją trzy główne typy autofagii wśród eukariontów: autofagia makro, mikro autofagia i autofagia zależna od opiekuna. O ile nie określono inaczej, termin autofagia odnosi się do autofagii makro..
Chociaż te trzy typy autofagii różnią się morfologicznie, wszystkie kończą się transportem substancji do lizosomów w celu degradacji i recyklingu..
Makroautofagia
Jest to rodzaj autofagii zależny od treningu de novo pęcherzyków fagocytarnych zwanych autofagosomami. Tworzenie się tych pęcherzyków jest niezależne od tworzenia się „pąków” błony, ponieważ powstają one w wyniku ekspansji.
U drożdży tworzenie autofagosomów rozpoczyna się w określonym miejscu znanym jako PAS, podczas gdy u ssaków wiele różnych miejsc występuje w cytozolu, prawdopodobnie połączonych z retikulum endoplazmatycznym strukturami znanymi jako „omegazomy”.
Wielkość autofagosomów jest bardzo zmienna i zależy od organizmu oraz rodzaju cząsteczki lub organelli, które ulegają fagocytozie. Może mieć średnicę od 0,4-0,9 μm u drożdży do 0,5-1,5 μm u ssaków..
Kiedy błony autofagosomu i lizosomu łączą się, ich zawartość jest mieszana i wtedy zaczyna się trawienie docelowych substratów autofagii. To organelle jest wtedy znane jako autolizosom..
Dla niektórych autorów makroautofagię można z kolei podzielić na autofagię indukowaną i autofagię podstawową. Indukowana makroautofagia jest wykorzystywana do produkcji aminokwasów po dłuższym okresie głodu.
Podstawowa makroautofagia odnosi się do mechanizmu konstytutywnego (który jest zawsze aktywny) niezbędnego do wymiany różnych składników cytozolowych i organelli wewnątrzkomórkowych.
Mikroautofagia
Ten rodzaj autofagii odnosi się do procesu, w którym zawartość cytoplazmatyczna jest wprowadzana do lizosomu poprzez wgłębienia zachodzące w błonie wspomnianych organelli..
Po wprowadzeniu do lizosomu pęcherzyki wytworzone przez te wgłębienia unoszą się swobodnie w świetle, aż zostaną poddane lizie, a ich zawartość zostanie uwolniona i zdegradowana przez określone enzymy..
Autofagia zależna od opiekuna
Ten rodzaj autofagii odnotowano tylko w przypadku komórek ssaków. W przeciwieństwie do makro-autofagii i mikro-autofagii, w których niektóre fragmenty cytozolu są nieswoiście fagocytowane, autofagia, w której pośredniczą chaperony, jest dość specyficzna, ponieważ zależy od obecności określonych sekwencji pentapeptydów w substratach, które będą fagocytowane..
Niektórzy badacze ustalili, że ten motyw pentapeptydowy jest powiązany z sekwencją KFERQ i występuje w ponad 30% białek cytozolowych.
Nazywa się to „za pośrednictwem białek opiekuńczych”, ponieważ białka opiekuńcze są odpowiedzialne za utrzymywanie tego konserwowanego motywu odsłoniętego w celu ułatwienia jego rozpoznania i zapobiegania fałdowaniu się białka..
Białka z tym znacznikiem są przemieszczane do światła lizosomu i tam ulegają degradacji. Wiele substratów degradacji to enzymy glikolityczne, czynniki transkrypcyjne i ich inhibitory, białka wiążące wapń lub lipidy, podjednostki proteasomów i niektóre białka biorące udział w transporcie pęcherzykowym..
Podobnie jak pozostałe dwa typy autofagii, autofagia zależna od opiekuna jest procesem regulowanym na wielu poziomach, od rozpoznawania znacznika po transport i degradację substratów w lizosomach..
funkcje
Jedną z głównych funkcji procesu autofagicznego jest eliminacja starzejących się lub „przestarzałych” organelli, które są znakowane różnymi drogami w celu ich degradacji w lizosomach..
Dzięki obserwacji mikroskopów elektronowych lizosomów w komórkach ssaków wykryto w nich obecność peroksysomów i mitochondriów..
Na przykład w komórce wątroby średni czas życia mitochondrium wynosi 10 dni, po czym ta organella jest fagocytowana przez lizosomy, gdzie ulega degradacji, a jej składniki są poddawane recyklingowi do różnych celów metabolicznych..
W warunkach niskiego stężenia składników odżywczych komórki mogą wywoływać tworzenie autofagosomów w celu selektywnego „wychwytywania” części cytozolu, a także trawionych metabolitów w tych autofagosomach, które mogą pomóc komórkom przetrwać, gdy warunki zewnętrzne są ograniczone z punktu widzenia. żywieniowy punkt widzenia.
Role w zdrowiu i rozwoju
Autofagia pełni ważne funkcje w restrukturyzacji komórek w procesie różnicowania, ponieważ uczestniczy w usuwaniu części cytozolowych, które nie są potrzebne w określonym czasie..
Ma również ważne konsekwencje dla zdrowia komórek, ponieważ jest częścią mechanizmów obronnych przed atakującymi wirusami i bakteriami..
Badania Yoshinori Ohsumi
Yoshinori Ohsumi, laureat Nagrody Nobla w 2016 roku, japoński badacz w dziedzinie fizjologii i medycyny, opisał molekularne mechanizmy autofagii u drożdży, badając metaboliczny los wielu białek i wakuoli tych jednokomórkowych organizmów..
W swojej pracy Ohsumi nie tylko zidentyfikował białka i szlaki zaangażowane w ten proces, ale także zademonstrował, w jaki sposób szlak autofagii jest regulowany dzięki działaniu białek zdolnych do „liczenia” różnych stanów metabolicznych..
Ich praca rozpoczęła się od precyzyjnych mikroskopowych obserwacji wakuoli podczas intensywnych wydarzeń degradacyjnych. Wakuole są uważane za miejsca przechowywania „śmieci” drożdży i resztek komórkowych..
Obserwując drożdże z wadliwymi zmutowanymi genotypami dla różnych genów związanych lub hipotetycznie powiązanych z autofagią (zwanych genami ATG) badaczowi i jego współpracownikom udało się opisać autofagiczny system drożdży na poziomie genetycznym.
Następnie ta grupa badaczy określiła główne cechy genetyczne białek kodowanych przez te geny i wniosła znaczący wkład w ich interakcję i tworzenie kompleksów odpowiedzialnych za inicjację i wykonanie autofagii u drożdży..
Dzięki pracy Yoshinori Ohsumi, dziś lepiej rozumiemy molekularne aspekty autofagii, a także jej ważne implikacje dla prawidłowego funkcjonowania komórek i narządów, z których się składamy..
Bibliografia
- Alberts, B., Johnson, A., Lewis, J., Morgan, D., Raff, M., Roberts, K. i Walter, P. (2015). Biologia molekularna komórki (6th ed.). Nowy Jork: Garland Science.
- Klionsky, D. J., & Emr, S. D. (2000). Autofagia jako regulowana droga degradacji komórek. Nauka, 290, 1717-1721.
- Mizushima, N. (2007). Autofagia: proces i funkcja. Geny i rozwój, dwadzieścia jeden, 2861-2873.
- Mizushima, Noboru i Komatsu, M. (2011). Autofagia: odnowa komórek i tkanek. Komórka, 147, 728-741.
- Rabinowitz, J. D. i White, E. (2010). Autofagia i metabolizm. Nauka, 330, 1344-1348.



Jeszcze bez komentarzy