
Historia boraksu, budowa, właściwości, zastosowania, synteza, zagrożenia
Plik boraks lub boran sodu jest oznaczeniem grupy związków chemicznych o podstawowym wzorze Nadwab4LUB7. Jest to higroskopijna sól zdolna do tworzenia licznych hydratów, dodatkowo wzbogacona strukturalnie obecnością pewnych metalicznych zanieczyszczeń.
Głównymi związkami, które otrzymują nazwę boraksu, są: bezwodny czteroboran sodu, Nadwab4LUB7; pentahydrat tetraboranu sodu (Nadwab4LUB7). 5HdwaLUB; i dekahydrat tetraboranu sodu, Nadwab4LUB7.10HdwaLub, lub jego odpowiednik, oktahydrat tetraboranu sodu, Nadwab4LUB5(O)4.8HdwaLUB.

Jak można docenić, wszystkie powyższe ciała stałe różnią się jedynie stopniem uwodnienia; niektóre mają więcej cząsteczek wody w kryształach niż inne. Fizycznie boraks wygląda jak solidne kawałki lub kryształy kredy (górne zdjęcie).
Boraks występuje naturalnie w sezonowych osadach jeziornych, suszonych przez parowanie. Boraks jest produkowany w Turcji, jeziorach Searles (Kalifornia), na pustyni Atacama, w Chile, Boliwii, Tybecie i Rumunii. Kryształy boraksu można otrzymać syntetycznie w powolnym procesie nukleacji; to znaczy taki, w którym preferowany jest wzrost kryształów.
Czteroboran sodu, bezwodny i dekahydrowany, jest słabo rozpuszczalny w zimnej wodzie; ale jego rozpuszczalność wzrasta wraz ze wzrostem temperatury. Następniedwab4LUB7.10HdwaLub jest bardzo rozpuszczalny w glikolu etylenowym, średnio rozpuszczalny w etanolu i słabo rozpuszczalny w acetonie; są to mniej polarne rozpuszczalniki niż woda.
Boraks ma liczne zastosowania, np. W produkcji detergentów i mydeł; jako środek zmniejszający palność materiałów celulozowych; w produkcji włókna szklanego; do czyszczenia twardych powierzchni, takich jak metale, szkło i ceramika; i między innymi w hamowaniu korozji.
Boraks działa drażniąco na oczy, skórę i drogi oddechowe. Po połknięciu może wywołać między innymi wymioty, biegunkę, zwiotczenie, próchnicę i drgawki. Obecnie podejrzewa się, że może mieć szkodliwy wpływ na rozrodczość człowieka.
Indeks artykułów
- 1 Historia
- 2 Struktura boraksu
- 3 kryształy
- 3.1 Mylenie z anionem boranowym
- 4 Właściwości
- 4.1 Nazwy
- 4.2 Masa cząsteczkowa
- 4.3 Wygląd fizyczny
- 4.4 Gęstość
- 4.5 Temperatura topnienia
- 4.6 Temperatura wrzenia
- 4.7 Rozpuszczalność w wodzie
- 4.8 Rozpuszczalność w rozpuszczalnikach organicznych
- 4.9 Współczynnik załamania światła (ηD)
- 4.10 Stabilność
- 4.11 Emisja światła
- 4.12 Reakcje
- 5 zastosowań
- 5.1 Działanie przeciwutleniające
- 5.2 Produkcja klejów
- 5.3 Ognioodporne
- 5.4 Produkcja szkła borokrzemianowego (Pyrex)
- 5.5 Emulgator
- 5.6 Środki czyszczące
- 5.7 Zastosowania medyczne
- 5,8 pH buforu
- 5.9 Spadek twardości wody
- 5.10 Nawozy i kompost
- 5.11 Konserwacja drewna
- 5.12 Strumień i topnik
- 5.13 Inne
- 6 Synteza
- 7 Ryzyka
- 8 Odniesienia
Fabuła
Historia boraksu jest zagmatwana. Podobno odkryto go w dnie jeziora w Tybecie, wyschniętego przez parowanie. Został przeniesiony w VIII wieku z Tybetu do Arabii Saudyjskiej, wzdłuż tzw. Jedwabnego Szlaku.
Termin „boraks” stał się popularny w wyniku licznych zastosowań, które znaleziono i sprzedawano pod nazwą 20 Mule Team Borax Tradermax, co odnosiło się do sposobu, w jaki boraks był transportowany przez pustynie Nevady i Kalifornii..
Inna wersja jego odkrycia wskazuje, że Egipcjanie wiedzieli o jego istnieniu od dawna, wykorzystując go do spawania metali za pomocą ciepła. Ponadto używali go w medycynie oraz w procesie mumifikacji. Boraks został przeniesiony do Europy w XIII wieku przez Marco Polo.
W połowie XIX wieku na pustyni Mogave odkryto duże złoża boraksu, które od tamtej pory stały się powszechne..
Struktura boraksu

Górny obraz przedstawia jony tworzące boraks, w szczególności odpowiadające ciału stałemu o składzie Nadwa[B4LUB5(O)4] · 8HdwaO (lub Nadwab4LUB710HdwaLUB).
Po pierwsze, struktura anionu w klatce [B.4LUB5(O)4]dwa- (chociaż powinien mieć dwie deprotonowane grupy -OH, -O-), w którym można zobaczyć ośmiokątny pierścień (cztery atomy B i cztery atomy O), z mostkiem B-O-B dzielącym go na dwie połowy.
Wspomniana klatka nie pozostaje statyczna, ale wibruje i przyjmuje różne kształty w przestrzeni; jednak w mniejszym stopniu w okolicach mostu. Można też zauważyć, że jest bardzo „dotleniony”; to znaczy ma wiele atomów tlenu, zdolnych do interakcji z cząsteczkami wody poprzez wiązania wodorowe.
Nic więc dziwnego, że kryształy boraksu mogą uwadniać i wytwarzać liczne hydraty. Tak więc dla stałego Nadwa[B4LUB5(O)4] · 8HdwaLub jest osiem cząsteczek H.dwaLub oddziaływanie z klatką boranową, a jednocześnie z metalowymi centrami Na+.
Po stronie kationów mamy kompleks wodny [Na (HdwaLUB)4]+n, gdzie wartość n będzie zależeć od stosunku anion / kation. W górnej bryle n = 2, więc mamy: [Nadwa(H.dwaLUB)8]dwa+, którego ładunek 2+ neutralizuje ładunek 2 anionu boranowego.
Kryształy
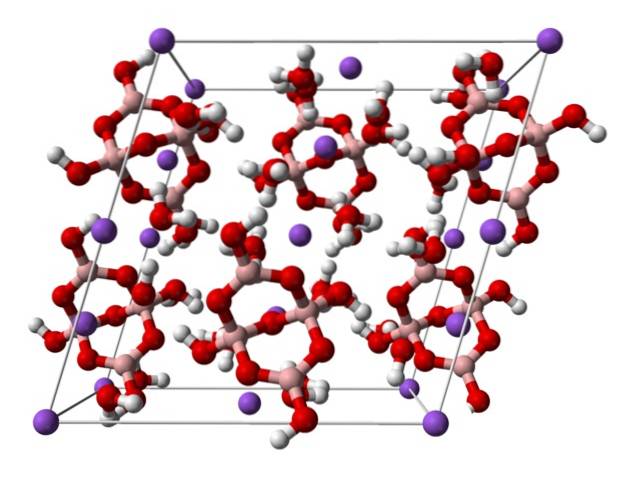
domena].
Powyżej znajduje się jednoskośna komórka elementarna dla kryształów Nadwa[B4LUB5(O)4] · 8HdwaO lub Nadwab4LUB710HdwaO. Tutaj przyciąganie elektrostatyczne i wiązania wodorowe rządzą lub dominują nad wzorcami strukturalnymi powstałymi w każdej rozpiętości kryształu..
Pozostałe hydraty i bezwodna sól tracą jedną lub wszystkie cząsteczki wody, zmieniając skład i strukturę kryształu boraksu. We wszystkich anion i kation pozostają takie same (chyba że występują zanieczyszczenia lub reakcje uboczne), więc nie może być zamieszania w tym względzie..
Mylenie z anionem boranowym
Nadwa[B4LUB5(O)4] · 8HdwaO i Nadwab4LUB710HdwaAlbo są takie same. Dlaczego?
Po pierwsze, jeśli policzysz jego atomy, zobaczysz, że ich liczba się pokrywa; a po drugie, w anionie B.4LUB7dwa- rozważa się brak dwóch grup OH połączonych z główkami boru mostków B-O-B; dwa OH, które razem z dwoma H+ pochodzący z B.4LUB7dwa-, dodaj 2 HdwaLub, dając w sumie 10 godzindwaLub (8 + 2).
Nieruchomości
Nazwy
- Boraks.
- Boran sodowy.
- Czteroboran sodu.
- Tetraboran disodu.
Masa cząsteczkowa
Bezwodny: 201,22 g / mol.
Dekawodzian: 381,38 g / mol.
Wygląd fizyczny
Białe krystaliczne ciało stałe.
Gęstość
Bezwodny: 2,4 g / cm3
Dekawodzian: 1,739 g / cm3
Temperatura topnienia
Bezwodny: 743 ° C (1369 ° F, 1016 K).
Dekawodzian: 75 ºC.
Temperatura wrzenia
Bezwodny: 1575 ° C (2867 ° F, 1848 K).
Rozpuszczalność w wodzie
31,78 g / l (zarówno w postaci bezwodnej, jak i dekawodzianu).
Rozpuszczalność w rozpuszczalnikach organicznych
Jest bardzo dobrze rozpuszczalny w glikolu etylenowym, średnio rozpuszczalny w glikolu dietylenowym i metanolu i słabo rozpuszczalny w acetonie..
Współczynnik załamania (ηD)
Bezwodny: η1 = 1447; ηdwa = 1469.
Dekawodzian: ηdwa = 1,472.
Stabilność
Jest stabilny w odpowiednich warunkach przechowywania. Chociaż ma niskie ciśnienie pary, rośnie wraz z temperaturą, prowadząc do krystalizacji i kondensacji, dlatego należy unikać nadmiernych wahań temperatury i wilgotności..
Emisja światła
Czteroboran sodu poddany działaniu ognia emituje zielone światło.
Reakcje
- Gdy rozpuszcza się w wodzie, wytwarza roztwory zasadowe o pH około 9,2.
- Boraks reaguje tworząc inne borany, takie jak nadboran (PBS).
- Wytwarza również kwas borowy w reakcji z kwasem solnym:
Nadwab4LUB710HdwaO + HCl => 4H3BO3 + 2 Na+ + 2 Cl- + 5 godzdwaLUB
- Tetraboran sodu zachowuje się jak substancja amfoteryczna, ponieważ w roztworze wodnym hydrolizuje i jest zdolny do neutralizacji kwasów. W ten sam sposób jest w stanie zneutralizować alkalia o wysokim stężeniu, unikając nadmiernego wzrostu pH pożywki..
Aplikacje
Boraks ma wiele zastosowań, zarówno u ludzi, jak i we wszystkich wykonywanych przez nich czynnościach..
Działanie przeciwutleniające
Boraks ma zdolność rozpuszczania tlenków. Z tego powodu jest używany do odzyskiwania metali, takich jak mosiądz, miedź, ołów i cynk..
Służy również do zapobiegania utlenianiu prętów metalowych w odlewniach. Boraks pokrywa swoją powierzchnię, z wyłączeniem powietrza, a tym samym zapobiega utlenianiu. Ponadto zapobiega korozji materiałów żelaznych w produkcji samochodów.
Rozpuszczalność boraksu w glikolu etylenowym jest użyteczna w preparatach przeciw zamarzaniu. Boraks neutralizuje kwaśne pozostałości, które powstają podczas rozkładu glikolu etylenowego, minimalizując utlenianie, któremu może ulec powierzchnia metali.
Produkcja klejów
- Boraks jest częścią formulacji kleju skrobiowego do papieru falistego i tektury.
- Jest środkiem peptyzującym do produkcji klejów na bazie kazeiny i dekstryny.
- Działa poprzez wzmocnienie materiałów adhezyjnych poprzez sieciowanie sprzężonych grup hydroksylowych.
Ognioodporny
Jest stosowany jako środek zmniejszający palność w materiałach celulozowych i innych polimerach zawierających grupy hydroksylowe. Oddziałuje poprzez różne mechanizmy, w tym tworzenie się szklistej warstwy, która ogranicza dostęp paliw.
Produkcja szkła borokrzemianowego (Pyrex)
Boraks jest źródłem boru używanym do produkcji szkła borokrzemianowego; charakteryzuje się wysoką temperaturą topnienia, niskim współczynnikiem rozszerzalności oraz dużą odpornością na szok termiczny.
Pozwala to na poddawanie go działaniu wysokich temperatur bez pęknięć, otrzymując nazwę szkła ogniotrwałego..
Szkło borokrzemianowe jest wykorzystywane do produkcji materiałów używanych w domu do pieczenia żywności. Znajduje również zastosowanie w laboratoriach w zlewkach, kolbach, cylindrach miarowych, pipetach itp..
Emulgator
Boraks wraz z innymi związkami służy do emulgowania mydeł i innych parafin. Znajduje również zastosowanie jako baza do produkcji balsamów, kremów i maści..
Środki czystości
- Jest dodawany w preparatach do czyszczenia twardych powierzchni, takich jak metale, szkło i ceramika.
- Znajduje zastosowanie w środkach do czyszczenia rąk, materiałach do polerowania i mydłach z detergentami do użytku w pralniach iw domu. Ponadto ułatwia usuwanie tłustych osadów z podłóg fabrycznych.
Zastosowania medyczne
- Stosowany jest w leczeniu grzybic stóp.
- Wchodzi w skład składników odżywczych dostarczających bor. Uważa się, że pierwiastek ten bierze udział w metabolizmie wapnia, fosforu i magnezu i może być niezbędny do budowy kości.
- Bierze udział w oznaczaniu glikozylowanej hemoglobiny (HbA1C), badaniu służącym do określenia długoterminowego rozwoju cukrzycy u pacjenta, ponieważ okres półtrwania erytrocytów wynosi 120 dni.
Informacje te są bardziej przydatne dla lekarza niż indywidualne pomiary stężenia glukozy we krwi pacjenta..
Bufor PH
Jest stosowany w różnych układach buforowych stosowanych w biochemii; wśród nich tris (hydroksymetylo) aminometanoboran, stosowany w poliakrylamidowej elektroforezie kwasów nukleinowych DNA i RNA.
Spadek twardości wody
Boraks może łączyć się z obecnymi w wodzie jonami wapnia i magnezu, zmniejszając ich stężenie. W ten sposób zmniejsza się twardość wody.
Nawóz i kompost
Boraks jest używany jako źródło boru. Wapń i bor biorą udział w tworzeniu ściany komórkowej roślin. Ponadto wskazano, że bor sprzyja zapylaniu, dlatego interweniuje w nawożeniu i rozmnażaniu roślin.
Konserwacja drewna
Borax walczy z kornikiem, chrząszczem, który zjada i niszczy drewno. Znajduje również zastosowanie w konserwacji i konserwacji drewnianych łodzi.
Strumień i strumień
Stosowany jest jako topnik przy spawaniu stali i żelaza, powodując obniżenie temperatury topnienia i eliminację tlenku żelaza; niepożądane zanieczyszczenie. W podobnym celu uczestniczy w lutowaniu złota i srebra.
Inni
- Jest stosowany jako łagodny pestycyd; na przykład do zwalczania ćmy na wełnie.
- Opryskiwanie stosuje się do zwalczania szkodników obecnych w szafach, zbiornikach wewnętrznych, w zagłębieniach ścian i ogólnie tam, gdzie nie jest pożądane stosowanie bardziej zanieczyszczających pestycydów..
- Jest stosowany w reaktorach jądrowych do kontrolowania reakcji, które w skrajnych przypadkach mogą wywołać reakcję łańcuchową.
- W grzejnikach samochodowych boraks służy do blokowania miejsc, w których występują wycieki wody.
Synteza
Boraks otrzymywany jest w wyniku reakcji mineralnego uleksytu, złożonego z pierwiastków boru, sodu i wapnia, o wzorze NaCaB5LUB9.8HdwaLub z węglanem sodu i wodorowęglanem sodu w środowisku wodnym.
W rzeczywistości synteza tetraboranu sodu lub boraksu jest rzadko stosowana; większość wytwarzanego związku uzyskuje się przez ekstrakcję zawartych w nim minerałów.
Proces można podsumować rozpuszczeniem rudy w wodzie, a następnie filtracją w glinie i ostatecznie odparowaniem wodnego roztworu.
Ryzyka
Boraks jest produktem naturalnym, jednak może powodować szereg szkód dla zdrowia ludzkiego. Na przykład kontakt z proszkiem boraksu może powodować podrażnienie skóry, które może prowadzić do zapalenia skóry..
Podobnie boraks powoduje podrażnienie oczu i górnych dróg oddechowych. Objawy jego wdychania to kaszel i ból gardła.
Tymczasem spożycie boraksu objawia się następującymi objawami: wymioty, nudności, biegunka, wiotkość, ból głowy i drgawki. Ponadto może to mieć wpływ na ośrodkowy układ nerwowy i czynność nerek..
W badaniach przeprowadzonych na samcach szczurów karmionych boraksem stwierdzono u nich zanik jąder. Podczas gdy badania przeprowadzone na ciężarnych samicach szczurów wykazały, że boraks może przenikać przez łożysko, powodując zmiany w rozwoju płodu, objawiające się niską masą urodzeniową.
Uważa się, że ekspozycja na boraks wpływa na funkcje rozrodcze u mężczyzn, objawiając się zmniejszeniem liczby plemników.
Szacuje się, że śmiertelna dawka boraksu u dorosłych wynosi od 10 do 25 gramów.
Bibliografia
- Shiver & Atkins. (2008). Chemia nieorganiczna. (Czwarta edycja). Mc Graw Hill.
- Narodowe Centrum Informacji Biotechnologicznej. (2019). Argon. Baza danych PubChem. CID = 23968. Odzyskany z: pubchem.ncbi.nlm.nih.gov
- Karolyn Burns, Seneca Joseph i Dr. Ryan Baumbach. (s.f.). Synteza i właściwości kryształów boraksu i stopów międzymetalicznych. Odzyskany z: nationalmaglab.org
- Wikipedia. (2019). Boraks. Odzyskane z: en.wikipedia.org
- Rio Tinto. (2019). Dekahydrat boraksu. 20 Mule Team Borax. Odzyskane z: borax.com
- Fletcher Jenna. (14 stycznia 2019). Czy boraks jest bezpieczny w użyciu? Odzyskany z: medicalnewstoday.com



Jeszcze bez komentarzy