
Charakterystyka, synteza i zastosowania bromku wodoru (HBr)

Plik bromowodór, związek chemiczny o wzorze HBr, jest cząsteczką dwuatomową z wiązaniem kowalencyjnym. Związek jest klasyfikowany jako halogenowodór, będący bezbarwnym gazem, który po rozpuszczeniu w wodzie tworzy kwas bromowodorowy, nasycając się przy 68,85% w / w w temperaturze pokojowej..
Wodne roztwory o stężeniu 47,6% w / w tworzą stałą wrzącą mieszaninę azeotropową wrzącą w temperaturze 124,3 stopni Celsjusza. Mniej stężone, wrzące roztwory uwalniają H2O, aż do osiągnięcia składu stałej wrzącej mieszaniny azeotropowej..
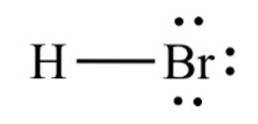
Indeks artykułów
- 1 Właściwości fizyczne i chemiczne
- 2 Reaktywność i zagrożenia
- 3 Transport i przechowywanie
- 4 Synteza
- 5 zastosowań
- 6 Odnośniki
Fizyczne i chemiczne właściwości
Bromowodór jest bezbarwnym gazem w temperaturze pokojowej o kwaśnym, drażniącym zapachu. Związek jest stabilny, ale stopniowo ciemnieje pod wpływem powietrza lub światła, jak pokazano na rysunku 2 (National Center for Biotechnology Information, S.F.).

Ma masę cząsteczkową 80,91 g / mol i gęstość 3,307 g / l, co czyni go cięższym od powietrza. Gaz skrapla się tworząc bezbarwną ciecz o temperaturze wrzenia -66,73 stopni Celsjusza.
Kontynuując chłodzenie, ciecz krzepnie, uzyskując białe kryształy o temperaturze topnienia -86,82 stopni Celsjusza i gęstości 2,603 g / ml (Egon Wiberg, 2001). Wygląd tych kryształów ilustruje rysunek 3.

Odległość wiązania między bromem i wodorem wynosi 1,414 angstremów, a ich energia dysocjacji wynosi 362,5 kJ / mol..
Bromowodór jest lepiej rozpuszczalny w wodzie niż chlorowodór, 221 g można rozpuścić w 100 ml wody o temperaturze 0 stopni Celsjusza, co odpowiada objętości 612 litrów tego gazu na każdy litr wody. Jest również rozpuszczalny w alkoholu i innych rozpuszczalnikach organicznych.
W roztworze wodnym (kwas bromowodorowy) dominują kwaśne właściwości HBr (podobnie jak w przypadku HF i HCl), aw przypadku wiązania wodoru z halogenem jest on słabszy w przypadku bromowodoru niż w chlorowodorze.
Dlatego też, jeśli chlor przepuszcza się przez bromowodór, obserwuje się tworzenie brązowych oparów charakterystycznych dla bromu cząsteczkowego. Reakcja, która to wyjaśnia, jest następująca:
2HBr + Cl2 → 2HCl + Br2
Wskazuje to, że bromowodór jest silniejszym środkiem redukującym niż chlorowodór i że chlorowodór jest lepszym środkiem utleniającym..
Bromowodór jest bezwodnym mocnym kwasem (bez wody). Reaguje szybko i egzotermicznie z wszelkiego rodzaju zasadami (w tym aminami i amidami).
Reaguje egzotermicznie z węglanami (w tym wapieniem i materiałami budowlanymi zawierającymi wapień) oraz wodorowęglanami, generując dwutlenek węgla.
Reaguje z siarczkami, węglikami, borkami i fosforekami, tworząc toksyczne lub łatwopalne gazy.
Reaguje z wieloma metalami (w tym aluminium, cynkiem, wapniem, magnezem, żelazem, cyną i wszystkimi metalami alkalicznymi), tworząc łatwopalny wodór.
Odpowiedz gwałtownie:
- Bezwodnik octowy
- 2-aminoetanol
- wodorotlenek amonu
- fosforek wapnia
- kwas chlorosulfonowy
- 1,1-difluoroetylen
- etylenodiamina
- etylenoimina
- dymiący kwas siarkowy
- kwas nadchlorowy
- b-propriolakton
- OXID propylenu
- nadchloran srebra
- Fosforek uranu (IV)
- octan winylu
- węglik wapnia
- węglik rubidu
- acetylenek cezu
- acetylenek rubidu
- borek magnezu
- siarczan rtęci (II)
- fosforek wapnia
- węglik wapnia (arkusz danych chemicznych, 2016).
Reaktywność i zagrożenia
Bromowodór jest sklasyfikowany jako żrący i drażniący związek. Jest wyjątkowo niebezpieczny w przypadku kontaktu ze skórą (drażniący i żrący) i oczami (drażniący) oraz w przypadku połknięcia i wdychania (drażniący płuca).
Związek jest przechowywany w zbiornikach z gazem skroplonym pod ciśnieniem. Długotrwałe narażenie na ogień lub intensywne ciepło może spowodować gwałtowne pęknięcie pojemnika pod ciśnieniem, który może zostać uwolniony, uwalniając drażniące toksyczne opary..
Długotrwałe narażenie na niskie stężenia lub krótkotrwałe narażenie na wysokie stężenia może powodować niekorzystne skutki zdrowotne spowodowane wdychaniem..
Rozkład termiczny bezwodnego bromowodoru wytwarza toksyczne gazy bromowe. Może stać się łatwopalny, jeśli zareaguje, uwalniając wodór. W kontakcie z cyjankiem wydzielają się toksyczne gazy cyjanowodór.
Wdychanie powoduje poważne podrażnienie nosa i górnych dróg oddechowych, które może spowodować uszkodzenie płuc..
Spożycie powoduje oparzenia ust i żołądka. Kontakt z oczami powoduje silne podrażnienia i oparzenia. Kontakt ze skórą powoduje podrażnienia i oparzenia.
Jeśli ta substancja chemiczna w roztworze wejdzie w kontakt z oczami, należy je natychmiast przepłukać dużą ilością wody, od czasu do czasu unosząc dolną i górną powiekę..
Podczas pracy z tą substancją chemiczną nie należy nosić soczewek kontaktowych. Jeśli tkanka oka jest zamarznięta, natychmiast zgłoś się do lekarza..
Jeśli tkanka nie jest zamarznięta, natychmiast i dokładnie przemywać oczy dużą ilością wody przez co najmniej 15 minut, od czasu do czasu unosząc dolną i górną powiekę..
Jeśli podrażnienie, ból, obrzęk lub łzawienie nie ustąpią, należy jak najszybciej zgłosić się do lekarza..
Jeśli ta substancja chemiczna w roztworze wejdzie w kontakt ze skórą i nie powoduje odmrożeń, należy natychmiast spłukać zanieczyszczoną skórę wodą.
Jeśli ta substancja chemiczna dostanie się na odzież, natychmiast zdejmij odzież i umyj skórę wodą.
Jeśli dojdzie do odmrożenia, należy natychmiast zgłosić się do lekarza. Nie należy pocierać dotkniętych obszarów ani spłukiwać wodą. Aby nie dopuścić do dalszych uszkodzeń tkanin, nie należy podejmować prób zdejmowania zamarzniętej odzieży z mrozów..
W przypadku wdychania dużych ilości tej substancji chemicznej narażoną osobę należy natychmiast wyprowadzić na świeże powietrze. Jeśli oddech ustał, wykonaj resuscytację usta-usta. Ofierze należy zapewnić ciepło i odpoczynek oraz jak najszybciej zwrócić się o pomoc lekarską..
Jeśli ta substancja chemiczna w roztworze została połknięta, natychmiast wezwij pomoc medyczną.
Obsługa i przechowywanie
Butle z bromowodorem należy przechowywać w chłodnym, dobrze wentylowanym miejscu. Podczas obchodzenia się z nim należy zapewnić odpowiednią wentylację. Powinien być przechowywany tylko wtedy, gdy temperatura nie przekracza 52 stopni Celsjusza.
Pojemniki powinny być mocno zabezpieczone w pozycji pionowej, aby zapobiec ich upadkowi lub uderzeniu. Załóż również kołpak ochronny zaworu, jeśli jest dostarczony, mocno na miejscu ręcznie, a także osobno przechowuj pełne i puste pojemniki (praxair inc., 2016).
Podczas przenoszenia produktu pod ciśnieniem należy stosować odpowiednio zaprojektowane instalacje hydrauliczne i sprzęt, aby wytrzymać napotykane ciśnienia. Nigdy nie pracuj w systemie pod ciśnieniem i nie używaj urządzenia zapobiegającego przepływowi zwrotnemu w rurociągu. Gazy mogą powodować szybkie uduszenie z powodu niedoboru tlenu.
Ważne jest przechowywanie i używanie przy odpowiedniej wentylacji. W przypadku wycieku zamknąć zawór pojemnika i zamknąć system w bezpieczny i przyjazny dla środowiska sposób. Następnie napraw wyciek. Nigdy nie umieszczaj pojemnika, w którym może być częścią obwodu elektrycznego.
Podczas obsługi butli należy nosić skórzane rękawice ochronne i odpowiednie buty. Muszą być one chronione iw tym celu należy ich unikać, ciągnąć, toczyć lub przesuwać..
Podczas przenoszenia butli zdejmowana pokrywa zaworu powinna być zawsze na miejscu. Nigdy nie próbuj podnosić butli za jej osłonę, która ma na celu wyłącznie ochronę zaworu..
Podczas przenoszenia butli, nawet na krótkie odległości, należy używać wózka (wózek, wózek ręczny itp.) Przeznaczonego do transportu butli.
Do otworów w pokrywie nie wolno nigdy wkładać żadnego przedmiotu (np. Klucza, śrubokręta, łomu), ponieważ może to spowodować uszkodzenie zaworu i wyciek..
Regulowany klucz pasowy służy do usuwania zbyt ciasnych lub zardzewiałych zaślepek. Zawór powinien otwierać się powoli, a jeśli to niemożliwe, przestań go używać i skontaktuj się z dostawcą. Oczywiście zawór na pojemniku musi być zamknięty po każdym użyciu..
Wspomniany pojemnik musi być zamknięty, nawet gdy jest pusty. Nigdy nie należy kierować płomienia ani miejscowego ciepła bezpośrednio na żadną część pojemnika. Wysokie temperatury mogą uszkodzić pojemnik i spowodować przedwczesną awarię urządzenia obniżającego ciśnienie, odpowietrzając zawartość pojemnika (praxair inc., 2016).
Synteza
Gazowy bromowodór można wytwarzać w laboratorium przez bromowanie tetraliny (1,2,3,4-tetrahydronaftalenu). Wadą jest to, że traci się połowę bromu. Wydajność wynosi około 94%, czyli tyle samo, 47% bromu kończy się jako HBr.
do10H.12 + 4 Brdwa → C10H.8Br4 + 4 HBr
Gazowy bromowodór można również syntetyzować w laboratorium w reakcji stężonego kwasu siarkowego z bromkiem sodu..
NaBr (s) + Hdwapołudniowy zachód4 → HBr (g) + NaHSO4
Wadą tej metody jest to, że większość produktu jest tracona w wyniku utleniania nadmiarem kwasu siarkowego z wytworzeniem bromu i dwutlenku siarki..
2 HBr + Hdwapołudniowy zachód4 → Brdwa + południowy zachóddwa + 2 godzdwaLUB
Bromowodór można wytworzyć w laboratorium w reakcji pomiędzy oczyszczonym gazowym wodorem i bromem. Katalizuje się go azbestem platynowym i przeprowadza się w rurze kwarcowej w temperaturze 250 ° C.
Brdwa + H.dwa[Pt] → 2 HBr
Bezwodny bromowodór można również wytwarzać na małą skalę przez termolizę bromku trifenylofosfoniowego w ksylenie pod chłodnicą zwrotną..
HBr można otrzymać metodą z czerwonym fosforem. Najpierw w reaktorze wodnym dodaje się czerwony fosfor, a następnie powoli, mieszając brom i reakcję kwasu bromowodorowego i fosforawego drogą sedymentacji, filtracji i otrzymaną destylację stanowi kwas bromowodorowy..
P.4+6 Brdwa+12 godzdwaO → 12 HBr + 4 H3PO3
Bromowodór przygotowany powyższymi metodami może zostać zanieczyszczony Brdwa, który można usunąć przepuszczając gaz przez roztwór fenolu w tetrachlorometanie lub innym odpowiednim rozpuszczalniku w temperaturze pokojowej, wytwarzając 2, 4, 6-tribromofenol i tym samym wytwarzając więcej HBr.
Proces ten można również przeprowadzić za pomocą wysokotemperaturowych wiórów miedzianych lub siatki miedzianej (wodór: bromowodór, 1993-2016).
Aplikacje
HBr jest używany do produkcji organicznych bromków, takich jak bromek metylu, bromoetan itp., Oraz nieorganicznych, takich jak bromek sodu, bromek potasu, bromek litu, bromek wapnia itp..
Jest również używany w zastosowaniach fotograficznych i farmaceutycznych lub do syntezy środków uspokajających i znieczulających. Ponadto znajduje zastosowanie w suszeniu przemysłowym, wykańczaniu tekstyliów, środkach powlekających, obróbce powierzchni i środkach przeciwogniowych..
Związek jest również używany do wytrawiania arkuszy polikrzemowych, do produkcji chipów komputerowych (Interscan Corporation, 2017).
Bromowodór jest dobrym rozpuszczalnikiem dla niektórych rud metali, używanym do rafinacji metali o wysokiej czystości.
W przemyśle naftowym służy do rozdzielania związków alkoksylowych i fenoksylowych oraz jako katalizator utleniania węglowodorów cyklicznych i węglowodorów łańcuchowych do ketonów, kwasu lub nadtlenku. Jest również stosowany w syntetycznych barwnikach i przyprawach..
Wysokiej jakości gaz HBr służy do trawienia i czyszczenia surowców półprzewodnikowych (SHOWA DENKO K.K, b.d.).
Związek jest stosowany jako odczynnik analityczny do oznaczania siarki, selenu, bizmutu, cynku i żelaza, do oddzielania cyny od arsenu i antymonu. Jest katalizatorem alkilowania i reduktorem stosowanym w syntezie organicznej.
Do produkcji kwasu bromowodorowego można użyć bromowodoru. Kwas bromowodorowy to bardzo mocny kwas mineralny, silniejszy od kwasu solnego.
HBr jest wysoce reaktywny i powoduje korozję większości metali. Kwas jest powszechnym odczynnikiem w chemii organicznej, używanym do utleniania i katalizy. Jest również skuteczny w ekstrakcji niektórych minerałów metalicznych (bromowodór, 2016).
Bibliografia
- Interscan Corporation. (2017). Aparatura do monitorowania bromowodoru i bromowodoru. Pobrane z gasdetection.com.
- Arkusz danych chemicznych. (2016). Pobrane z HYDROGEN BROMIDE, BEZWODNY: cameochemicals.noaa.gov.
- Egon Wiberg, N. W. (2001). Chemia nieorganiczna. Prasa akademicka.
- Bromowodór. (2016). Pobrane z ChemicalBook.
- Wodór: bromowodór. (1993-2016). Pobrane z WebElements.
- Karta charakterystyki materiału Bromowodór. (2005, 9 października). Odzyskany z sciencelab.com.
- Narodowe Centrum Informacji Biotechnologicznej. (S.F.). Baza danych PubChem Compound; CID = 260. Pobrane z pubchem.ncbi.nlm.nih.gov.
- praxair inc. (2016, 17 października). Bromowodór bezwodny Karta charakterystyki P-4605. Pobrane z praxair.com.
- SHOWA DENKO K.K. (s.f.). bromowodór. Pobrane z www.sdk.co.jp.


Jeszcze bez komentarzy