
Struktura, właściwości, zastosowania i zagrożenia butanalu
Plik butanal jest aldehydem o otwartym łańcuchu, składającym się z czterech atomów węgla i jest analogiczny do butanu; w rzeczywistości jest to druga najbardziej utleniona forma węglowodoru butanu po kwasie masłowym. Jego wzór cząsteczkowy to CH3CHdwaCHdwaCHO, gdzie -CHO oznacza grupę formylową.
Ten aldehyd, jeden z najlżejszych, składa się z przezroczystej, łatwopalnej cieczy o mniejszej gęstości niż woda. Ponadto jest rozpuszczalny w wodzie i miesza się z większością rozpuszczalników organicznych; dlatego może być stosowany do jednofazowych mieszanin organicznych.
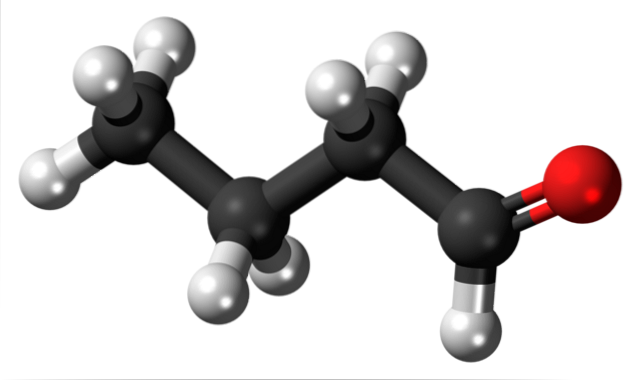
Obecność grupy karbonylowej (tej z czerwonej kuli, górny obraz) nadaje cząsteczce butanalu chemiczną polarność, a tym samym możliwość doświadczania interakcji dipol-dipol między jej cząsteczkami; chociaż nie powstają między nimi wiązania wodorowe.
Powoduje to, że butanal ma wyższą temperaturę wrzenia i topnienia niż butan, ale niższą niż te prezentowane przez alkohol n-butylowy..
Butanal jest używany jako rozpuszczalnik i jest półproduktem do otrzymywania wielu produktów; takie jak przyspieszacze wulkanizacji kauczuków, żywic, farmaceutyków i agrochemikaliów.
Butanal jest toksycznym związkiem, który przez wdychanie może powodować zapalenie górnych dróg oddechowych, oskrzeli i obrzęk płuc, który może mieć nawet śmiertelne konsekwencje.
Indeks artykułów
- 1 Struktura butanalu
- 1.1 Zgodni
- 2 Właściwości
- 2.1 Nazwy chemiczne
- 2.2 Wzór cząsteczkowy
- 2.3 Wygląd fizyczny
- 2.4 Zapach
- 2.5 Temperatura wrzenia
- 2.6 Temperatura topnienia
- 2.7 Temperatura zapłonu
- 2.8 Rozpuszczalność w wodzie
- 2.9 Rozpuszczalność w rozpuszczalnikach organicznych
- 2.10 Gęstość
- 2.11 Gęstość par
- 2.12 Prężność par
- 2.13 Samozapłon
- 2.14 Lepkość
- 2.15 Ciepło spalania
- 2.16 Ciepło parowania
- 2.17 Napięcie powierzchniowe
- 2.18 Próg zapachu
- 2.19 Współczynnik załamania światła
- 2.20 Moment dipolowy
- 2.21 Długości fal (λ) przy maksymalnej absorpcji w wodzie
- 2.22 Polimeryzacja
- 2.23 Reaktywność
- 2.24 Kondensacja aldoli
- 3 Synteza
- 4 Zastosowania
- 4.1 Przemysłowe
- 4.2 Inne
- 5 Ryzyka
- 6 Odnośniki
Struktura butanalu
Wspomniano właśnie, że grupa formylowa -CHO nadaje polarność cząsteczce butanalu lub aldehydu masłowego ze względu na wyższą elektroujemność atomu tlenu. W rezultacie jego cząsteczki mogą oddziaływać ze sobą poprzez siły dipol-dipol..
Na górnym obrazku za pomocą modelu sfer i słupków pokazano, że cząsteczka butanalu ma strukturę liniową. Węgiel grupy -CHO ma hybrydyzację spdwa, podczas gdy pozostałe węgle sp. hybrydyzacja3.
Nie tylko to, ale jest również elastyczny, a jego połączenia mogą obracać się wokół własnych osi; iw ten sposób generowane są różne konformacje lub konformery (ten sam związek, ale z obróconymi łączami).
Zgodni
Poniższy obraz lepiej wyjaśnia ten punkt:
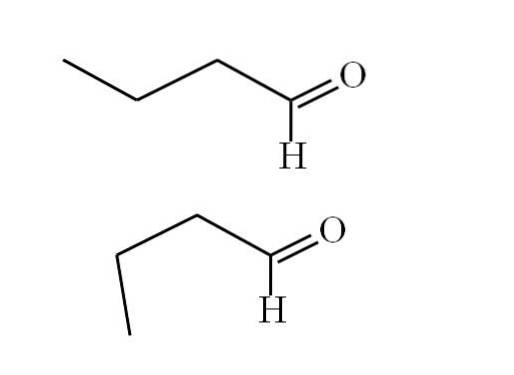
Pierwszy konformer (górny) odpowiada cząsteczce na pierwszym obrazku: grupie metylowej po lewej stronie, -CH3, a grupa -CHO są w pozycjach przeciwrównoległych względem siebie; jeden skierowany jest odpowiednio w górę, a drugi w dół.
Tymczasem drugi konformer (niższy) odpowiada cząsteczce z -CH3 i -CHO w zaćmionych pozycjach; to znaczy, że oba wskazują w tym samym kierunku.
Oba konformery są szybko zamienne, dlatego cząsteczka butanalu stale się obraca i wibruje; i dodał fakt, że ma stały dipol, dzięki czemu jego oddziaływania mogą być wystarczająco silne, aby wrzeć w 74,8ºC..
Nieruchomości
Nazwy chemiczne
-Butanal
-Aldehyd masłowy
-1-butanal
-Butyral
-N-butyraldehyd.
Formuła molekularna
do4H.8O lub CH3CHdwaCHdwaCHO.
Wygląd fizyczny
Jest to klarowna, przezroczysta ciecz.
Zapach
Charakterystyczny, ostry, aldehydowy zapach.
Temperatura wrzenia
167ºF do 760 mmHg (74,8ºC).
Temperatura topnienia
-146 ° F (-96,86 ° C).
punkt zapłonu
-Zamknięty tygiel 8ºF (-22ºC).
Rozpuszczalność w wodzie
7 g / 100 ml w 25 ° C.
Rozpuszczalność w rozpuszczalnikach organicznych
Mieszalny z etanolem, eterem, octanem etylu, acetonem, toluenem i wieloma innymi rozpuszczalnikami organicznymi.
Gęstość
0,803 g / cm3 w 68ºF.
Gęstość pary
2,5 (w stosunku do pobranego powietrza równego 1).
Ciśnienie pary
111 mmHg przy 25 ºC.
Samozapłon
446ºF. 425ºF (21,8ºC).
Lepkość
0,45 cPuazy w 20 ° C.
Ciepło spalania
2479,34 kJ / mol w 25 ° C.
Ciepło parowania
33,68 kJ / mol w 25 ° C.
Napięcie powierzchniowe
29,9 dyn / cm w 24 ° C.
Próg zapachu
0,009 ppm.
Współczynnik załamania światła
1,3843 przy 20 ºC.
Moment dipolowy
2,72 D.
Długości fal (λ) przy maksymalnej absorpcji w wodzie
225 nm i 282 nm (światło ultrafioletowe).
Polimeryzacja
Butanal może polimeryzować w kontakcie z alkaliami lub kwasami, polimeryzacja jest niebezpieczna.
Reaktywność
Pod wpływem powietrza utlenia się, tworząc kwas masłowy. W temperaturze 230ºC butanal zapala się samorzutnie z powietrzem.
Kondensacja aldoli
Dwie cząsteczki butanalu mogą reagować ze sobą w obecności KOH i w temperaturze 6-8 ° C, tworząc związek 2-etylo-3-hydroksyheksanol. Ten rodzaj związku nazywany jest aldolem, ponieważ ma w swojej strukturze grupę aldehydową i grupę alkoholową.
Synteza
Butanal można wytwarzać przez katalityczne odwodornienie alkoholu n-butylowego; katalityczne uwodornienie aldehydu krotonowego; oraz hydroformylowanie propylenu.
Aplikacje
Przemysłowy
-Butanal jest rozpuszczalnikiem przemysłowym, ale jest również półproduktem w syntezie innych rozpuszczalników; na przykład 2-etyloheksanol, n-butanol i trimetylopropan.
-Znajduje również zastosowanie jako półprodukt do produkcji żywic syntetycznych, w tym poliwinylobutyralu; przyspieszacze wulkanizacji gumy; produkcja wyrobów farmaceutycznych; środki ochrony roślin; pestycydy; przeciwutleniacze; środki wspomagające opalanie.
-Butanal jest używany jako surowiec do produkcji syntetycznych aromatów. Ponadto jest stosowany jako środek aromatyzujący do żywności.
Inni
-U ludzi butanal jest stosowany jako biomarker wskazujący na uszkodzenie oksydacyjne, którego doświadczają lipidy, białka i kwasy nukleinowe.
-Został użyty eksperymentalnie, razem z formaliną i glutardehydem, aby spróbować zmniejszyć zmiękczenie, jakiego doświadczają kopyta bydła w wyniku kontaktu z wodą, moczem i odchodami samego bydła. Wyniki eksperymentów były pozytywne.
Ryzyka
Butanal działa niszcząco na błony śluzowe górnych dróg oddechowych, a także na tkanki skóry i oczu..
W kontakcie ze skórą powoduje zaczerwienienia i oparzenia. W oczach występują te same urazy, którym towarzyszy ból i uszkodzenie tkanki oka.
Wdychanie butanalu może mieć poważne konsekwencje, ponieważ może powodować stan zapalny i obrzęk krtani i oskrzeli; będąc w płucach, wywołuje chemiczne zapalenie płuc i obrzęk płuc.
Objawy nadmiernego narażenia obejmują: uczucie pieczenia w górnych drogach oddechowych, kaszel, świszczący oddech, tj. Świszczący oddech podczas oddychania; zapalenie krtani, duszność, bóle głowy, nudności, a także wymioty.
Wdychanie może być śmiertelne w wyniku skurczu dróg oddechowych.
Spożycie butanalu powoduje uczucie „pieczenia” w przewodzie pokarmowym: jamie ustnej, gardle, przełyku i żołądku.
Bibliografia
- Morrison, R. T. and Boyd, R. N. (1987). Chemia organiczna. (5ta Wydanie.). Od redakcji Addison-Wesley Iberoamericana.
- Carey F. (2008). Chemia organiczna. (Wydanie szóste). Mc Graw Hill.
- PubChem. (2019). Butanal. Odzyskany z: pubchem.ncbi.nim.nih.guv
- Wikipedia. (2019). Butanal. Odzyskane z: es.wikipedia.org
- Książka chemiczna. (2017). Butanal. Odzyskane z: chemicalbook.com
- Basf. (Maj 2017). N-butyraldehyd. [PDF]. Odzyskany z :olvents.basf.com


Jeszcze bez komentarzy