
Charakterystyka butenu, budowa chemiczna i zastosowanie
Plik butyn to nazwa nadana serii czterech izomerów o wzorze chemicznym C.4H.8. Są to alkeny lub olefiny, to znaczy mają w swojej strukturze wiązanie podwójne C = C. Ponadto są to węglowodory, które można znaleźć na polach naftowych lub powstać w wyniku krakingu termicznego i uzyskać produkty o niższej masie cząsteczkowej..
Cztery izomery reagują z tlenem, uwalniając ciepło i żółty płomień. Podobnie mogą reagować z szerokim spektrum małych cząsteczek, które dodają się do ich podwójnego wiązania..
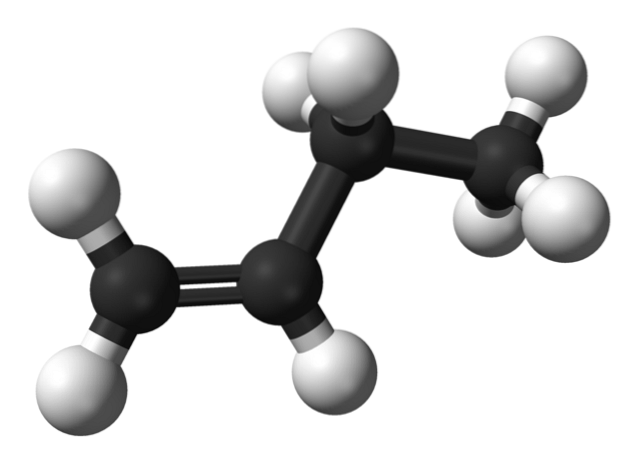
Ale jakie są izomery butenu? Na górnym obrazku strukturę przedstawiają białe (atomy wodoru) i czarne (węgle) kule dla 1-butenu. Najprostszym izomerem węglowodoru C jest 1-buten4H.8. Zwróć uwagę, że istnieje osiem białych i cztery czarne kule, co jest zgodne z wzorem chemicznym.
Pozostałe trzy izomery to cis i trans 2-buten oraz izobuten. Wszystkie z nich wykazują bardzo podobne właściwości chemiczne, chociaż ich budowa powoduje różnice we właściwościach fizycznych (temperatura topnienia i wrzenia, gęstość itp.). Ponadto ich widma IR mają podobne wzory pasm absorpcji..
Potocznie 1-buten jest nazywany butenem, chociaż 1-buten odnosi się tylko do pojedynczego izomeru, a nie do nazwy rodzajowej. Te cztery związki organiczne to gazy, ale mogą skraplać się pod wysokim ciśnieniem lub skraplać (a nawet krystalizować) wraz ze spadkiem temperatury..
Są źródłem ciepła i energii, odczynnikami do syntezy innych związków organicznych, a przede wszystkim są niezbędne do produkcji sztucznego kauczuku po syntezie butadienu..
Indeks artykułów
- 1 Charakterystyka butenu
- 1.1 Masa cząsteczkowa
- 1.2 Aspekty fizyczne
- 1.3 Temperatura wrzenia
- 1.4 Temperatura topnienia
- 1.5 Rozpuszczalność
- 1.6 Gęstość
- 1.7 Reaktywność
- 2 Struktura chemiczna
- 2.1 Izomery konstytucyjne i geometryczne
- 2.2 Stabilność
- 2.3 Siły międzycząsteczkowe
- 3 Zastosowania
- 4 Odnośniki
Charakterystyka butenu
Waga molekularna
56,106 g / mol. Ta waga jest taka sama dla wszystkich izomerów o wzorze C4H.8.
Aspekty fizyczne
Jest to gaz bezbarwny i łatwopalny (podobnie jak inne izomery) o stosunkowo aromatycznym zapachu..
Temperatura wrzenia
Temperatury wrzenia izomerów butenu są następujące:
1-buten: -6ºC
Cis-2-buten: 3,7 ° C
Trans-2-buten: 0,96ºC
2-metylopropen: -6,9 ° C
Temperatura topnienia
1-buten: -185,3ºC
Cis-2-buten: -138,9 ° C
Trans-2-buten: -105,5 ° C
2-metylopropen: -140,4 ° C
Rozpuszczalność
Buten jest bardzo nierozpuszczalny w wodzie ze względu na swój niepolarny charakter. Jednak doskonale rozpuszcza się w niektórych alkoholach, benzenie, toluenie i eterach..
Gęstość
0,577 przy 25 ° C Dlatego jest mniej gęsty niż woda iw pojemniku znajdowałby się nad nią..
Reaktywność
Jak każdy alken, jego podwójne wiązanie jest podatne na dodawanie cząsteczek lub utlenianie. To sprawia, że buten i jego izomery są reaktywne. Z drugiej strony są to substancje łatwopalne, więc przegrzane reagują z tlenem zawartym w powietrzu..
Struktura chemiczna
Na górnym obrazku przedstawiona jest struktura 1-butenu. Po jego lewej stronie widać położenie podwójnego wiązania między pierwszym a drugim węglem. Cząsteczka ma strukturę liniową, chociaż region wokół wiązania C = C jest płaski z powodu hybrydyzacji spdwa tych węgli.
Gdyby cząsteczka 1-butenu została obrócona pod kątem 180º, miałaby tę samą cząsteczkę bez widocznych zmian, dlatego brakuje jej aktywności optycznej.
Jak oddziaływałyby jego cząsteczki? Wiązania C-H, C = C i C-C są z natury niepolarne, więc żadne z nich nie współpracuje w tworzeniu momentu dipolowego. W konsekwencji cząsteczki CHdwa= CHCHdwaCH3 musi współdziałać za pomocą londyńskich sił dyspersyjnych.
Prawy koniec butenu tworzy chwilowe dipole, które w niewielkiej odległości polaryzują sąsiednie atomy sąsiedniej cząsteczki. Ze swojej strony lewy koniec wiązania C = C oddziałuje, nakładając chmury π jedna na drugą (jak dwie płytki lub arkusze).
Ponieważ szkielet molekularny składa się z czterech atomów węgla, ich interakcje ledwo wystarczają, aby faza ciekła miała temperaturę wrzenia -6ºC..
Izomery konstytucyjne i geometryczne
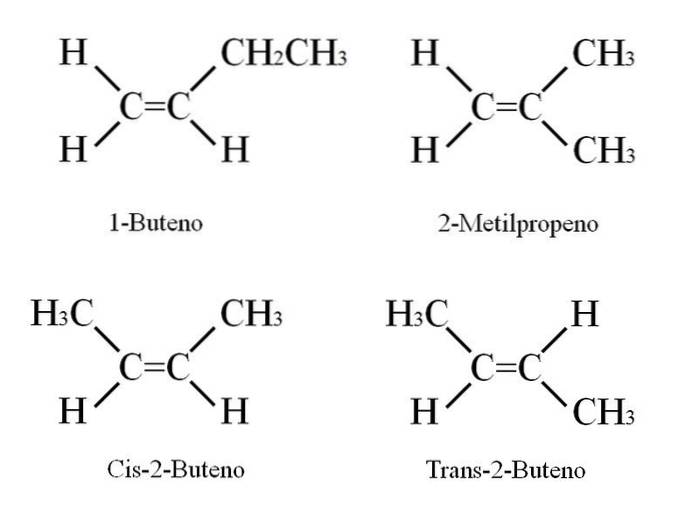
1-buten ma wzór cząsteczkowy C.4H.8; Jednak inne związki mogą mieć taką samą proporcję atomów C i H w swojej strukturze..
Jak to jest możliwe? Jeśli uważnie obserwuje się strukturę 1-butenu, podstawniki na węglach C = C można zamienić. Podczas tej wymiany powstają inne związki z tego samego szkieletu. Ponadto pozycja podwójnego wiązania między C-1 i C-2 może przesunąć się w kierunku C-2 i C-3: CH3CH = CHCH3, 2-buten.
W 2-butenie atomy H mogą znajdować się po tej samej stronie podwójnego wiązania, co odpowiada stereoizomerowi cis; lub w odwrotnej orientacji przestrzennej, w stereoizomerze trans. Oba tworzą tak zwane izomery geometryczne. To samo dotyczy grup -CH3.
Zwróć również uwagę, że gdyby pozostał w cząsteczce CH3CH = CHCH3 atomy H po jednej stronie i grupy CH3 w innym, konstytucyjny izomer byłby otrzymany: CHdwa= C (CH3)dwa, 2-metylopropen (znany również jako izobuten).
Te cztery związki mają ten sam wzór C4H.8 ale inne struktury. 1-buten i 2-metylopropen są izomerami konstytucyjnymi; i cis i trans-2-buten, izomery geometryczne między nimi dwoma (i konstytucyjne w stosunku do reszty).
Stabilność
Ciepło spalania
Który z czterech izomerów na powyższym obrazku przedstawia najbardziej stabilną strukturę? Odpowiedź można znaleźć na przykład w cieple spalania każdego z nich. Reagując z tlenem, izomer o wzorze C4H.8 zamienia się w COdwa uwalnianie wody i ciepła:
do4H.8(g) + 6Odwa(g) => 4COdwa(g) + 4HdwaO (g)
Spalanie jest egzotermiczne, więc im więcej ciepła jest uwalniane, tym bardziej niestabilny jest węglowodór. Dlatego jeden z czterech izomerów, który podczas spalania w powietrzu oddaje najmniej ciepła, będzie najbardziej stabilny..
Ciepła spalania dla czterech izomerów to:
-1-buten: 2717 kJ / mol
-cis-2-buten: 2710 kJ / mol
-trans-2-buten: 2707 kJ / mol
-2-metylopropen: 2700 kJ / mol
Należy zauważyć, że 2-metylopropen jest izomerem wydzielającym najmniej ciepła. Podczas gdy 1-buten jest tym, który uwalnia więcej ciepła, co przekłada się na większą niestabilność.
Efekt steryczny i elektroniczny
Tę różnicę w trwałości między izomerami można wywnioskować bezpośrednio ze struktury chemicznej. Według alkenów ten, który ma więcej podstawników R, uzyskuje większą stabilizację swojego podwójnego wiązania. Zatem 1-buten jest najbardziej niestabilny, ponieważ prawie nie ma podstawnika (-CHdwaCH3); to znaczy jest monopodstawiony (RHC = CHdwa).
Izomery cis i trans 2-butenu różnią się energią z powodu naprężenia Van der Wall'a wywołanego efektem sterycznym. W izomerze cis dwie grupy CH3 po tej samej stronie podwójnego wiązania odpychają się, podczas gdy w izomerze trans są wystarczająco daleko od siebie.
Ale dlaczego w takim razie 2-metylopropen jest najbardziej stabilnym izomerem? Ponieważ efekt elektroniczny interweniuje.
W tym przypadku, nawet jeśli jest to dipodstawiony alken, dwie grupy CH3 są na tym samym węglu; w pozycji bliźniaczej względem siebie. Grupy te stabilizują węgiel podwójnego wiązania, dając mu część jego chmury elektronowej (ponieważ jest on stosunkowo bardziej kwaśny z powodu hybrydyzacji sp).dwa).
Ponadto w 2-butenie jego dwa izomery mają tylko 2 ° węgla; podczas gdy 2-metylopropen zawiera trzeci węgiel o większej stabilności elektronicznej.
Siły międzycząsteczkowe
Stabilność czterech izomerów jest logiczna, ale siły międzycząsteczkowe nie. Jeśli porównamy ich temperatury topnienia i wrzenia, okaże się, że nie są one zgodne z tą samą kolejnością.
Można by oczekiwać, że trans-2-buten będzie wykazywał największe siły międzycząsteczkowe ze względu na większy kontakt powierzchniowy między dwiema cząsteczkami, w przeciwieństwie do cis-2-butenu, którego szkielet przyciąga C. Jednak cis-2-buten wrze w wyższej temperaturze (3,7 ° C), niż izomer trans (0,96 ° C).
Oczekiwano by podobnych temperatur wrzenia dla 1-butenu i 2-metylopropenu, ponieważ są one strukturalnie bardzo podobne. Jednak w stanie stałym różnica zmienia się radykalnie. 1-buten topi się w temperaturze -185,3 ° C, a 2-metylopropen w temperaturze -140,4 ° C.
Ponadto izomer cis-2-butenu topi się w temperaturze -138,9 ° C, w temperaturze bardzo zbliżonej do 2-metylopropenomu, co może oznaczać, że w ciele stałym mają one równie stabilny układ.
Z tych danych można wywnioskować, że pomimo znajomości najbardziej stabilnych struktur, nie rzucają one wystarczającego światła na wiedzę o działaniu sił międzycząsteczkowych w cieczy; a nawet więcej, w fazie stałej tych izomerów.
Aplikacje
-Buteny, biorąc pod uwagę ich ciepło spalania, mogą być po prostu wykorzystane jako źródło ciepła lub paliwa. Zatem można by oczekiwać, że płomień 1-butenu będzie się bardziej nagrzewał niż inne izomery..
-Mogą być używane jako rozpuszczalniki organiczne.
-Służą jako dodatki podnoszące poziom oktanowy benzyny.
-W ramach syntezy organicznej 1-buten bierze udział w produkcji innych związków, takich jak: tlenek butylenu, 2-glutanol, sukcynoimid i tert-butylomekaptan (używany do nadawania gazowi kuchennemu charakterystycznego zapachu). Podobnie butadien (CHdwa= CH-CH = CHdwa), z którego syntetyzuje się sztuczną gumę.
Poza tymi syntezami różnorodność produktów będzie zależeć od tego, które cząsteczki zostaną dodane do podwójnego wiązania. Na przykład halogenki alkilu można syntetyzować, poddając je reakcji z halogenami; alkohole, jeśli dodają wodę w środowisku kwaśnym; i estry tert-butylowe, jeśli dodają alkohole o niskiej masie cząsteczkowej (takie jak metanol).
Bibliografia
- Francis A. Carey. Chemia organiczna. Kwasy karboksylowe. (wydanie szóste, strony 863-866). Mc Graw Hill.
- Wikipedia. (2018). Butyn Zaczerpnięte z: es.wikipedia.org
- YPF. (Lipiec 2017). Buten nas. [PDF]. Zaczerpnięte z: ypf.com
- William Reusch. (5 maja 2013). Reakcje addycji alkenów. Odzyskane z: 2.chemistry.msu.edu
- PubChem. (2018). 1-buten. Odzyskany z: pubchem.ncbi.nlm.nih.gov



Jeszcze bez komentarzy