
Efektywna koncepcja ładunku jądrowego, jak to obliczyć i przykłady
Plik Skuteczne ładunki jądrowe (Zef) to siła przyciągania wywierana przez jądro na którykolwiek z elektronów po zmniejszeniu jej przez efekt ekranowania i penetracji. Gdyby nie było takich efektów, elektrony odczuwałyby siłę przyciągania prawdziwego ładunku jądrowego Z..
Na poniższym obrazku mamy model atomowy Bohra dla fikcyjnego atomu. Jego jądro ma ładunek jądrowy Z = + n, który przyciąga elektrony krążące wokół niego (niebieskie kółka). Można zauważyć, że dwa elektrony znajdują się na orbicie bliżej jądra, podczas gdy trzeci elektron znajduje się w większej odległości od niego..
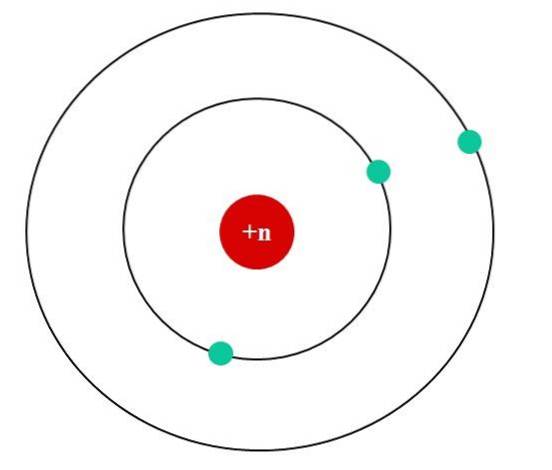
Trzeci elektron krąży po orbicie czując elektrostatyczne odpychanie pozostałych dwóch elektronów, więc jądro przyciąga go z mniejszą siłą; to znaczy, oddziaływanie jądro-elektron zmniejsza się w wyniku ekranowania pierwszych dwóch elektronów.
Zatem pierwsze dwa elektrony odczuwają siłę przyciągania ładunku + n, ale trzeci doświadcza zamiast tego efektywnego ładunku jądrowego + (n-2)..
Jednak wspomniany Zef byłby ważny tylko wtedy, gdyby odległości (promień) do jądra wszystkich elektronów były zawsze stałe i określone, lokalizując ich ujemne ładunki (-1).
Indeks artykułów
- 1 Koncepcja
- 1.1 Efekty penetracji i osłony
- 2 Jak to obliczyć?
- 2.1 Reguła Slatera
- 3 przykłady
- 3.1 Wyznacz Zef dla elektronów na orbicie 2s2 w berylu
- 3.2 Wyznacz Zef dla elektronów na orbicie 3p3 luminoforu
- 4 Odnośniki
Pojęcie
Protony definiują jądra pierwiastków chemicznych, a elektrony określają ich tożsamość w ramach zestawu cech (grupy układu okresowego)..
Protony zwiększają ładunek jądrowy Z w tempie n + 1, co jest kompensowane przez dodanie nowego elektronu w celu stabilizacji atomu.
Wraz ze wzrostem liczby protonów jądro jest „pokryte” dynamiczną chmurą elektronów, w której regiony, przez które krążą, są określone przez rozkłady prawdopodobieństwa promieniowych i kątowych części funkcji falowych (orbitali).
Z tego podejścia elektrony nie krążą w określonym obszarze przestrzeni wokół jądra, ale raczej, jak łopatki szybko obracającego się wentylatora, wtapiają się w kształty znanych orbitali s, p, d i f.
Z tego powodu ujemny ładunek -1 elektronu jest rozprowadzany przez te regiony, przez które przenikają orbitale; im większy efekt penetracji, tym większy efektywny ładunek jądrowy, którego wspomniany elektron doświadczy na orbicie.
Efekty penetracji i osłony
Zgodnie z powyższym wyjaśnieniem, elektrony w powłokach wewnętrznych nie wnoszą ładunku -1 do stabilizującego odpychania elektronów w powłokach zewnętrznych..
Jednak to jądro (powłoki wcześniej wypełnione elektronami) służy jako „ściana”, która zapobiega docieraniu siły przyciągania jądra do zewnętrznych elektronów..
Nazywa się to efektem ekranu lub efektem osłony. Ponadto nie wszystkie elektrony w zewnętrznych powłokach doświadczają tej samej wielkości tego efektu; na przykład, jeśli zajmujesz orbital o silnie penetrującym charakterze (to znaczy, który przechodzi bardzo blisko jądra i innych orbitali), poczujesz wyższy Zef.
W rezultacie powstaje rząd stabilności energetycznej jako funkcja tych Zef dla orbitali: s Oznacza to, że orbital 2p ma wyższą energię (mniej stabilizowaną ładunkiem jądra) niż orbital 2s.. Im słabszy efekt penetracji wywierany przez orbital, tym mniejszy będzie efekt ekranowania pozostałych elektronów zewnętrznych. Orbitale di f wykazują wiele dziur (węzłów), w których jądro przyciąga inne elektrony. Zakładając, że ładunki ujemne są zlokalizowane, wzór na obliczenie Zef dla dowolnego elektronu jest następujący: Zef = Z - σ W tym wzorze σ jest stałą ekranowania wyznaczoną przez elektrony jądra. Dzieje się tak, ponieważ teoretycznie najbardziej zewnętrzne elektrony nie przyczyniają się do ekranowania wewnętrznych elektronów. Innymi słowy, 1sdwa osłona elektronu 2s1, ale 2s1 nie osłania elektronów Z 1sdwa. Jeśli Z = 40, pomijając wspomniane efekty, to ostatni elektron doświadczy Zef równego 1 (40-39). Reguła Slatera jest dobrym przybliżeniem wartości Zef dla elektronów w atomie. Aby go zastosować, wykonaj poniższe czynności: 1- Elektroniczną konfigurację atomu (lub jonu) należy zapisać w następujący sposób: (1s) (2s 2p) (3s 3p) (3d) (4s 4p) (4d) (4f)… 2- Elektrony znajdujące się na prawo od rozpatrywanego nie przyczyniają się do efektu ekranowania. 3- Elektrony należące do tej samej grupy (zaznaczone w nawiasach) zapewniają 0,35 ładunku elektronu, chyba że jest to grupa 1s, czyli 0,30. 4- Jeśli elektron zajmuje orbital s lub p, wówczas wszystkie orbitale n-1 wnoszą 0,85, a wszystkie orbitale n-2 stanowią jednostkę. 5- W przypadku, gdy elektron zajmuje orbital d lub f, wszystkie te po jego lewej stronie wnoszą jedną jednostkę. Zgodnie ze sposobem reprezentacji Slatera, elektroniczna konfiguracja Be (Z = 4) to: (1sdwa) (2sdwa2 P0) Ponieważ na orbicie znajdują się dwa elektrony, jeden z nich przyczynia się do ekranowania drugiego, a orbital 1s to n-1 orbitalu 2s. Następnie, rozwijając sumę algebraiczną, otrzymujemy: (0,35) (1) + (0,85) (2) = 2,05 0,35 pochodzi z elektronu 2s, a 0,85 z dwóch elektronów 1s. Teraz stosując formułę Zefa: Zef = 4 - 2,05 = 1,95 Co to znaczy? Oznacza to, że elektrony na orbicie 2sdwa doświadczają ładunku +1,95, który przyciąga ich do rdzenia, a nie faktycznego ładunku +4. Znowu postępuje tak, jak w poprzednim przykładzie: (1sdwa) (2sdwa2 P6) (3 sdwa3p3) Teraz suma algebraiczna jest opracowywana w celu określenia σ: (, 35) (4) + (0,85) (8) + (1) (2) = 10,2 Tak więc Zef jest różnicą między σ i Z: Zef = 15-10,2 = 4,8 Podsumowując, ostatnie 3p elektrony3 doświadczają obciążenia trzykrotnie mniejszego niż rzeczywiste. Należy również zauważyć, że zgodnie z tą zasadą elektrony 3sdwa doświadczyć tego samego Zefa, co może budzić wątpliwości. Istnieją jednak modyfikacje reguły Slatera, które pomagają w przybliżeniu obliczonych wartości rzeczywistych..Jak to obliczyć?
Reguła Slatera
Przykłady
Wyznacz Zef dla elektronów na orbicie 2sdwa w berylu
Wyznacz Zef dla elektronów na orbicie 3p3 fosforu
Bibliografia



Jeszcze bez komentarzy