
Składniki ogniw elektrochemicznych, sposób działania, rodzaje, przykład
Plik ogniwa elektrochemiczne Są to urządzenia, w których zachodzą reakcje chemiczne, w których energia chemiczna zamieniana jest na energię elektryczną lub odwrotnie. Komórki te stanowią serce elektrochemii, a dusza jest potencjalną wymianą elektronów, która może nastąpić spontanicznie lub nie, między dwoma rodzajami chemicznymi..
Jeden z dwóch gatunków utlenia się, traci elektrony, podczas gdy drugi ulega redukcji, uzyskując przeniesione elektrony. Zwykle redukuje się kation metaliczny w roztworze, który w wyniku pozyskania elektronów jest osadzany elektrycznie na elektrodzie wykonanej z tego samego metalu. Z drugiej strony utleniającym się związkiem jest metal, który przekształca się w kationy metali.
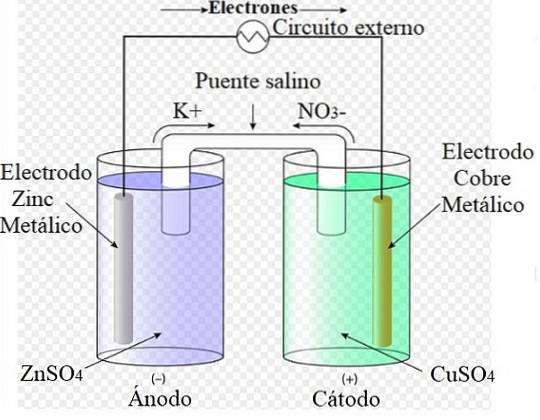
Na przykład powyższy obrazek przedstawia komórkę Daniela: najprostsze ze wszystkich ogniw elektrochemicznych. Metaliczna elektroda cynkowa utlenia się, uwalniając kationy Zndwa+ do środowiska wodnego. Dzieje się tak w pojemniku ZnSO4 po lewej.
Po prawej roztwór zawierający CuSO4 jest zredukowana, przekształcając kationy Cudwa+ w metalicznej miedzi osadzonej na elektrodzie miedzianej. Podczas rozwoju tej reakcji elektrony przemieszczają się przez obwód zewnętrzny, aktywując jego mechanizmy; a tym samym dostarczanie energii elektrycznej do pracy zespołu.
Indeks artykułów
- 1 Elementy ogniw elektrochemicznych
- 1.1 Elektrody
- 1.2 Rozpuszczanie elektrolitów
- 1.3 Most solny
- 2 Rodzaje ogniw elektrochemicznych i sposób ich działania
- 2.1 Galwaniczne
- 2.2 Elektrolityki
- 3 przykłady
- 3.1 Cela Daniela
- 3.2 Ogniwo platynowe i wodorowe
- 3.3 Komórka Downs
- 4 Odnośniki
Komponenty ogniw elektrochemicznych
Elektrody
Prądy elektryczne są generowane lub pobierane w ogniwach elektrochemicznych. Aby zapewnić odpowiedni przepływ elektronów, muszą istnieć materiały, które są dobrymi przewodnikami elektryczności. Tutaj wchodzą elektrody i obwód zewnętrzny, zaopatrzony w miedziane, srebrne lub złote przewody..
Elektrody to materiały, które zapewniają powierzchnię, na której będą zachodzić reakcje w ogniwach elektrochemicznych. Istnieją dwa typy w zależności od reakcji, która w nich zachodzi:
-Anoda, elektroda, w której zachodzi utlenianie
-Katoda, elektroda, w której następuje redukcja
Elektrody mogą być wykonane z reagującego materiału, jak w przypadku ogniwa Daniela (cynk i miedź); lub materiał obojętny, na przykład gdy są wykonane z platyny lub grafitu.
Elektrony uwolnione przez anodę muszą dotrzeć do katody; ale nie przez roztwór, ale przez metalowy kabel, który łączy obie elektrody z obwodem zewnętrznym.
Rozpuszczanie elektrolitu
Ważną rolę odgrywa również roztwór otaczający elektrody, wzbogacony o mocne elektrolity; takie jak: KCl, KNO3, NaCl itp. Jony te sprzyjają w pewnym stopniu migracji elektronów z anody do katody, a także ich przewodzeniu przez otoczenie elektrod w celu interakcji z substancjami podlegającymi redukcji..
Na przykład woda morska przewodzi prąd znacznie lepiej niż woda destylowana, przy niższym stężeniu jonów. Dlatego ogniwa elektrochemiczne mają w swoich składnikach rozpuszczanie silnych elektrolitów..
Most solny
Jony roztworu zaczynają otaczać elektrody powodując polaryzację ładunków. Roztwór wokół katody zaczyna się ładować ujemnie, gdy kationy są redukowane; w przypadku komórki Daniela kationy Cudwa+ osadzając się jako metaliczna miedź na katodzie. W ten sposób zaczyna pojawiać się deficyt ładunków dodatnich.
W tym miejscu interweniuje mostek solny, aby zrównoważyć ładunki i zapobiec polaryzacji elektrod. W kierunku boku lub przedziału katody kationy będą migrować z mostka solnego, K+ lub Zndwa+, aby wyprzeć Cudwa+ strawiony. W międzyczasie z mostka solnego nie będą migrować aniony NO3- w kierunku komory anodowej, aby zneutralizować rosnące stężenie kationów Zndwa+.
Mostek solny składa się z nasyconego roztworu soli, którego końce są pokryte żelem przepuszczalnym dla jonów, ale nieprzepuszczalnym dla wody..
Rodzaje ogniw elektrochemicznych i ich działanie
Sposób działania ogniwa elektrochemicznego zależy od jego typu. Zasadniczo istnieją dwa typy: galwaniczne (lub galwaniczne) i elektrolityczne.
Galwaniczny
Przykładem galwanicznego ogniwa elektrochemicznego jest ogniwo Daniela. W nich reakcje zachodzą spontanicznie, a potencjał baterii jest dodatni; im wyższy potencjał, tym więcej energii elektrycznej dostarczy ogniwo.
Ogniwa lub baterie to właśnie ogniwa galwaniczne: potencjał chemiczny między dwiema elektrodami jest przekształcany w energię elektryczną, gdy interweniuje obwód zewnętrzny, który je łączy. W ten sposób elektrony migrują z anody, zapalają sprzęt, do którego podłączona jest bateria i wracają bezpośrednio do katody.
Elektrolityczny
Ogniwa elektrolityczne to takie, których reakcje nie zachodzą spontanicznie, chyba że są zasilane energią elektryczną z zewnętrznego źródła. Tutaj zachodzi zjawisko odwrotne: elektryczność umożliwia niespontaniczne reakcje chemiczne.
Jedną z najbardziej znanych i cennych reakcji zachodzących w tego typu ogniwie jest elektroliza..
Akumulatory to przykłady ogniw elektrolitycznych i jednocześnie galwanicznych: są one ładowane w celu odwrócenia ich reakcji chemicznych i przywrócenia warunków początkowych do ponownego wykorzystania..
Przykłady
Cela Daniela
Następujące równanie chemiczne odpowiada reakcji w komórce Daniela, w której uczestniczą cynk i miedź:
Zn (s) + Cudwa+(aq) → Zndwa+(aq) + Cu (s)
Ale kationy Cudwa+ i Zndwa+ nie są one same, ale towarzyszą im aniony SO4dwa-. Tę komórkę można przedstawić w następujący sposób:
Zn | ZnSO4 | | KIERUNEK4 | Cu
Komórkę Daniela można zbudować w dowolnym laboratorium, co jest bardzo powtarzalną praktyką we wprowadzaniu elektrochemii. Ponieważ Cudwa+ osadza się jako Cu, niebieski kolor roztworu CuSO4 będzie zgubiony.
Platynowe ogniwo wodorowe
Wyobraź sobie ogniwo, które zużywa wodór, produkuje metaliczne srebro i jednocześnie dostarcza energię elektryczną. To jest ogniwo platynowe i wodorowe, a jego ogólna reakcja wygląda następująco:
2AgCl (s) + Hdwa(g) → 2Ag (s) + 2H+ + 2Cl-
Tutaj, w komorze anodowej, mamy obojętną elektrodę platynową, zanurzoną w wodzie, do której pompowany jest wodór. Hdwa utlenia się do H.+ i przekazuje swoje elektrony do mlecznego osadu AgCl w komorze katody z metaliczną srebrną elektrodą. Na tym srebrze AgCl zostanie zredukowany, a masa elektrody wzrośnie..
Tę komórkę można przedstawić jako:
Pt, H.dwa | H.+ | | Cl-, AgCl | Ag
Komórka Downs
I wreszcie, wśród ogniw elektrolitycznych mamy ogniwo ze stopionego chlorku sodu, lepiej znane jako ogniwo Downsa. Tutaj energia elektryczna jest wykorzystywana, aby objętość stopionego NaCl przechodziła przez elektrody, powodując w ten sposób następujące reakcje:
2Na+(l) + 2e- → 2Na (s) (katoda)
2Cl-(l) → Cldwa(g) + 2e- (anoda)
2NaCl (l) → 2Na (s) + Cldwa(g) (reakcja globalna)
W ten sposób dzięki elektryczności i chlorkowi sodu można przygotować metaliczny sód i chlor gazowy..
Bibliografia
- Whitten, Davis, Peck & Stanley. (2008). Chemia. (8th ed.). CENGAGE Learning.
- Wikipedia. (2020). Ogniwo elektrochemiczne. Odzyskane z: en.wikipedia.org
- Helmenstine, dr Anne Marie (29 stycznia 2020). Ogniwa elektrochemiczne. Odzyskany z: thinkco.com
- R. Ship. (s.f.). Ogniwa elektrochemiczne. Odzyskane z: hyperphysics.phy-astr.gsu.edu
- Chemicool. (2017). Definicja ogniwa elektrochemicznego. Źródło: chemicool.com
- Patricia Jankowski. (2020). Co to jest ogniwo elektrochemiczne? - Struktura i zastosowania. Nauka. Odzyskany z: study.com
- Alchemia (3 marca 2011). Ogniwa elektrochemiczne. Chemia i nauka. Odzyskane z: laquimicaylaciencia.blogspot.com



Jeszcze bez komentarzy