
Struktura, właściwości, synteza i zastosowania cykloheksenu
Plik cykloheksen jest cyklicznym alkenem lub olefiną o wzorze cząsteczkowym C6H.10. Składa się z bezbarwnej cieczy, nierozpuszczalnej w wodzie i mieszającej się z wieloma rozpuszczalnikami organicznymi. Charakteryzuje się łatwopalnością iw naturze zwykle występuje w smole węglowej.
Cykloheksen jest syntetyzowany przez częściowe uwodornienie benzenu i odwodnienie cykloheksanolu alkoholu; to znaczy bardziej utlenioną formę. Podobnie jak inne cykloalkeny, ulega reakcji addycji elektrofilowej i wolnorodnikowej; na przykład reakcja halogenowania.

Ten cykliczny alken (górna ilustracja) tworzy mieszaniny azeotropowe (nierozdzielne przez destylację) z niższymi alkoholami i kwasem octowym. Nie jest bardzo stabilny przy długotrwałym przechowywaniu, ponieważ rozkłada się pod wpływem światła słonecznego i promieniowania ultrafioletowego.
Cykloheksen jest używany jako rozpuszczalnik, dlatego ma wiele zastosowań, takich jak: stabilizator benzyny wysokooktanowej oraz do ekstrakcji olejów.
Najważniejsze jest jednak to, że cykloheksen służy jako półprodukt i surowiec do otrzymywania wielu wysoce przydatnych związków, w tym: cykloheksanonu, kwasu adypinowego, kwasu maleinowego, cykloheksanu, butadienu, kwasu cykloheksylokarboksylowego itp..
Indeks artykułów
- 1 Struktura cykloheksenu
- 1.1 Oddziaływania międzycząsteczkowe
- 2 Właściwości
- 2.1 Nazwy chemiczne
- 2.2 Masa cząsteczkowa
- 2.3 Wygląd fizyczny
- 2.4 Zapach
- 2.5 Temperatura wrzenia
- 2.6 Temperatura topnienia
- 2.7 Temperatura zapłonu
- 2.8 Rozpuszczalność w wodzie
- 2.9 Rozpuszczalność w rozpuszczalnikach organicznych
- 2.10 Gęstość
- 2.11 Gęstość par
- 2.12 Prężność par
- 2.13 Samozapłon
- 2.14 Rozkład
- 2.15 Lepkość
- 2.16 Ciepło spalania
- 2.17 Ciepło parowania
- 2.18 Napięcie powierzchniowe
- 2.19 Polimeryzacja
- 2.20 Próg zapachu
- 2.21 Współczynnik załamania światła
- 2,22 pH
- 2.23 Stabilność
- 2.24 Reakcje
- 3 Synteza
- 4 Zastosowania
- 5 Ryzyka
- 6 Odnośniki
Struktura cykloheksenu
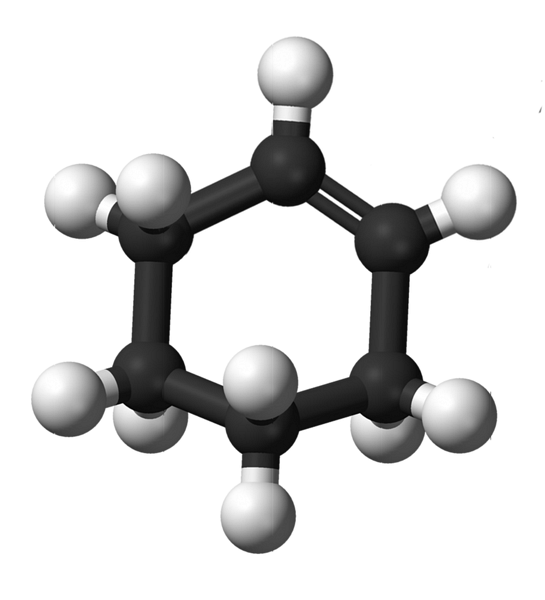
Górny obraz przedstawia strukturę cykloheksenu z modelem kul i prętów. Zwróć uwagę na sześciowęglowy pierścień i podwójne wiązanie, oba nienasycone związki. Z tej perspektywy wydaje się, że pierścień jest płaski; ale wcale tak nie jest.
Po pierwsze, węgle podwójnego wiązania mają hybrydyzację spdwa, co daje im geometrię płaszczyzny trygonalnej. Dlatego te dwa węgle i te przylegające do nich znajdują się w tej samej płaszczyźnie; podczas gdy dwa atomy węgla na przeciwległym końcu (do wiązania podwójnego) znajdują się powyżej i poniżej wspomnianej płaszczyzny.
Poniższy obrazek doskonale ilustruje to, co właśnie zostało wyjaśnione.

Zwróć uwagę, że czarny pasek składa się z czterech atomów węgla: dwóch z wiązaniem podwójnym i pozostałych przylegających do nich. Odsłonięta perspektywa to taka, którą można by uzyskać, gdyby widz umieścił oko bezpośrednio przed wiązaniem podwójnym. Można wtedy zobaczyć, że węgiel znajduje się powyżej i poniżej tej płaszczyzny.
Ponieważ cząsteczka cykloheksenu nie jest statyczna, dwa atomy węgla będą się wymieniać: jeden opadnie, a drugi wzniesie się ponad płaszczyznę. Można więc oczekiwać, że ta cząsteczka będzie się zachowywać.
Oddziaływania międzycząsteczkowe
Cykloheksen jest węglowodorem, dlatego jego oddziaływania międzycząsteczkowe opierają się na siłach dyspersji londyńskiej.
Dzieje się tak, ponieważ cząsteczka jest niepolarna, bez stałego momentu dipolowego, a jej masa cząsteczkowa jest czynnikiem, który najbardziej przyczynia się do utrzymania jej spójności w cieczy..
Podobnie podwójne wiązanie zwiększa stopień interakcji, ponieważ nie może poruszać się z taką samą elastycznością jak inne węgle, a to sprzyja interakcji między sąsiednimi cząsteczkami. Z tego powodu cykloheksen ma nieco wyższą temperaturę wrzenia (83ºC) niż cykloheksan (81ºC)..
Nieruchomości
Nazwy chemiczne
Cykloheksen, tetrahydrobenzen.
Waga molekularna
82,146 g / mol.
Wygląd fizyczny
Bezbarwna ciecz.
Zapach
Słodki zapach.
Temperatura wrzenia
83 ºC przy 760 mmHg.
Temperatura topnienia
-103,5 ° C.
punkt zapłonu
-7 ºC (zamknięty tygiel).
Rozpuszczalność w wodzie
Praktycznie nierozpuszczalny (213 mg / L).
Rozpuszczalność w rozpuszczalnikach organicznych
Mieszalny z etanolem, benzenem, czterochlorkiem węgla, eterem naftowym i acetonem. Oczekuje się, że jest on zdolny do rozpuszczania związków niepolarnych, takich jak niektóre alotropy węgla..
Gęstość
0,810 g / cm3 przy 20ºC.
Gęstość pary
2,8 (w stosunku do powietrza przyjmowanego jako równe 1).
Ciśnienie pary
89 mmHg przy 25ºC.
Samozapłon
244 ºC.
Rozkład
Rozkłada się w obecności soli uranu pod wpływem światła słonecznego i promieniowania ultrafioletowego.
Lepkość
0,625 mPaskala w temperaturze 25 ºC.
Ciepło spalania
3 751,7 kJ / mol w 25 ° C.
Ciepło parowania
30,46 kJ / mol w 25 ºC.
Napięcie powierzchniowe
26,26 mN / m.
Polimeryzacja
Może ulegać polimeryzacji w określonych warunkach.
Próg zapachu
0,6 mg / m3.
Współczynnik załamania światła
1,4465 w 20 ° C.
pH
7-8 do 20ºC.
Stabilność
Cykloheksen nie jest bardzo stabilny podczas długotrwałego przechowywania. Narażenie na światło i powietrze może prowadzić do produkcji nadtlenków. Jest również niekompatybilny z silnymi utleniaczami..
Reakcje
-Cykloalkeny podlegają głównie reakcjom addycji, zarówno elektrofilowym, jak iz wolnymi rodnikami.
-Reaguje z bromem, tworząc 1,2-dibromocykloheksan.
-Szybko utlenia się w obecności nadmanganianu potasu (KMnO4).
-Jest zdolny do wytwarzania epoksydu (tlenku cykloheksenu) w obecności kwasu nadbenzoesowego.
Synteza
Cykloheksen jest wytwarzany przez katalizę kwasową cykloheksanolu:
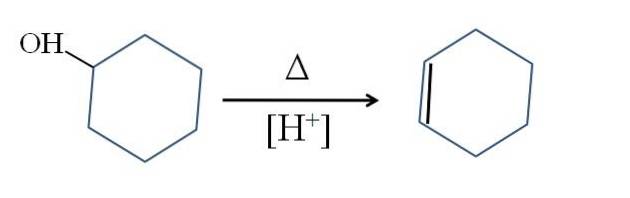
Symbol Δ reprezentuje ciepło niezbędne do promowania wyjścia grupy OH jako cząsteczki wody w środowisku kwaśnym (-OHdwa+).
Cykloheksen jest również wytwarzany przez częściowe uwodornienie benzenu; to znaczy, dwa z jego podwójnych wiązań dodają cząsteczkę wodoru:
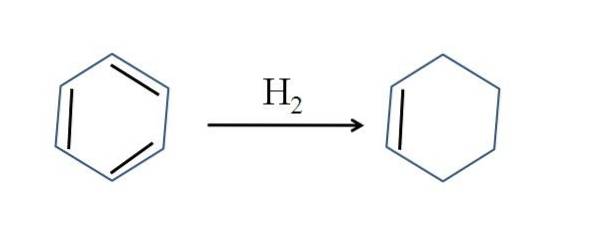
Chociaż reakcja wydaje się prosta, wymaga dużych ciśnień H.dwa i katalizatory.
Aplikacje
-Ma zastosowanie jako rozpuszczalnik organiczny. Ponadto jest surowcem do produkcji kwasu adypinowego, aldehydu adypinowego, kwasu maleinowego, cykloheksanu i kwasu cykloheksylokarboksylowego..
-Wykorzystywany jest do produkcji chlorku cykloheksanu, związku stosowanego jako półprodukt do produkcji wyrobów farmaceutycznych oraz dodatku do gumy.
-Cykloheksen jest również wykorzystywany w syntezie cykloheksanonu, surowca do produkcji leków, pestycydów, perfum i barwników..
-Cykloheksen bierze udział w syntezie aminocykloheksanolu, związku używanego jako środek powierzchniowo czynny i emulgator.
-Ponadto cykloheksen można stosować do laboratoryjnego wytwarzania butadienu. Ten ostatni jest używany do produkcji kauczuku syntetycznego, do produkcji opon samochodowych, a także do produkcji tworzyw akrylowych..
-Cykloheksen jest surowcem do syntezy lizyny, fenolu, żywicy policykloolefinowej i dodatków gumowych.
-Służy jako stabilizator benzyny wysokooktanowej.
-Przyczynia się do syntezy powłok wodoodpornych, folii odpornych na pęknięcia i spoiw wiążących do powłok.
Ryzyka
Cykloheksen nie jest związkiem bardzo toksycznym, ale przy kontakcie może powodować zaczerwienienie skóry i oczu. Wdychanie może wywołać kaszel i senność. Ponadto jego spożycie może powodować senność, duszność i nudności..
Cykloheksen jest słabo wchłaniany z przewodu pokarmowego, dlatego po połknięciu nie oczekuje się poważnych skutków ogólnoustrojowych. Maksymalnym powikłaniem jest jego aspiracja przez układ oddechowy, co może spowodować chemiczne zapalenie płuc.
Bibliografia
- Joseph F. Chiang i Simon Harvey Bauer. (1968). Struktura molekularna cykloheksenu. J. Am Chem. Soc. 1969, 91, 8, 1898-1901.
- Karry Barnes. (2019). Cykloheksen: zagrożenia, synteza i struktura. Nauka. Odzyskany z: study.com
- Morrison, R. T. and Boyd, R. N. (1987). Chemia organiczna. (5ta Wydanie.). Od redakcji Addison-Wesley Iberoamericana.
- PubChem. (2019). Cykloheksen. Odzyskany z: pubchem.ncbi.nlm.nih.gov
- Książka chemiczna. (2019). Cykloheksen. Odzyskane z: chemicalbook.com
- Sieć danych toksykologicznych. (2017). Cykloheksen. Toxnet. Odzyskany z: toxnet.nlm.nih.gov
- Chemoksy. (s.f.). Wzór strukturalny dla cykloheksenu to. Źródło: chemoxy.com



Jeszcze bez komentarzy