
Struktura, właściwości, zastosowanie kwasu fosforowego (H3PO4)

Plik Kwas fosforowy Jest to oksokwas fosforu o wzorze chemicznym H.3PO4. Składa się z kwasu mineralnego, w którym trzy kwasowe protony są związane z anionem fosforanowym (PO43-). Chociaż nie jest uważany za mocny kwas, jego niewłaściwe użycie może stanowić zagrożenie dla zdrowia.
Występuje w dwóch stanach: jako ciało stałe w postaci grubych rombowych kryształów lub krystaliczna ciecz o syropowatym wyglądzie. Jego najczęstsza postać handlowa ma stężenie 85% w / w i gęstość 1,685 g / cm3. Ta gęstość pochodzi z ręki koncentracji.
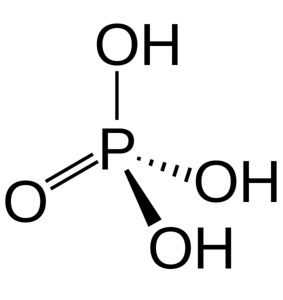
Trzy grupy OH są odpowiedzialne za oddawanie kwaśnych wodorów. Ze względu na ich obecność w swojej strukturze może reagować z różnymi wodorotlenkami pochodzącymi z różnych soli.
W przypadku wodorotlenku sodu może tworzyć trzy: jednozasadowy fosforan sodu (NaHdwaPO4), dwuzasadowy fosforan sodu (NadwaHPO4) i trójzasadowy fosforan sodu (Na3PO4).
Jednak w zależności od tego, która zasada zostanie użyta do jej zobojętnienia lub które kationy są jej bardzo bliskie, może tworzyć inne sole fosforanowe. Wśród nich są: fosforan wapnia (Ca3(PO4)dwa), fosforan litu (Li3PO4), fosforan żelaza (FePO4), i inni. Każdy z różnymi stopniami protonowania anionu fosforanowego.
Z drugiej strony kwas fosforowy może „sekwestrować” dwuwartościowe kationy, takie jak Fedwa+, Cudwa+, ACdwa+ i Mgdwa+. W podwyższonych temperaturach może reagować ze sobą z utratą cząsteczki H.dwaLub tworząc dimery, trimery i polimery kwasów fosforowych.
Ten typ reakcji sprawia, że związek ten jest zdolny do tworzenia dużej liczby struktur ze szkieletami fosforowymi i tlenowymi, z których można również otrzymać szeroką gamę soli zwanych polifosforanami..
Jeśli chodzi o jego odkrycie, został zsyntetyzowany w 1694 roku przez Roberta Boyle'a, rozpuszczając P.dwaLUB5 (pięciotlenek fosforu) w wodzie. Jest jednym z najbardziej użytecznych kwasów mineralnych, a jego funkcja jako nawozu jest najważniejsza. Fosfor to obok potasu i azotu trzy główne składniki pokarmowe roślin.
Indeks artykułów
- 1 Struktura chemiczna
- 1.1 Kwas difosforowy (H4P2O7)
- 1.2 Kwasy polifosforowe
- 1.3 Cykliczne kwasy polifosforowe
- 2 Nazewnictwo
- 2.1 Orto
- 2.2 Pyro
- 2.3 Gol
- 3 Właściwości
- 3.1 Wzór cząsteczkowy
- 3.2 Masa cząsteczkowa
- 3.3 Wygląd fizyczny
- 3.4 Temperatury wrzenia i topnienia
- 3.5 Rozpuszczalność w wodzie
- 3.6 Gęstość
- 3.7 Gęstość par
- 3.8 Samozapłon
- 3.9 Lepkość
- 3.10 Kwasowość
- 3.11 Rozkład
- 3.12 Korozyjność
- 3.13 Polimeryzacja
- 4 Zastosowania
- 4.1 Sole fosforanowe i zastosowania ogólne
- 4.2 Przemysłowe
- 4.3 Stomatologia
- 4.4 Kosmetyki
- 5 Tworzenie kwasu fosforowego
- 6 Ryzyka
- 7 Referencje
Struktura chemiczna
Kwas fosforowy składa się z wiązania P = O i trzech P-OH, z których te ostatnie są nośnikami kwaśnych wodorów uwalnianych w środowisku rozpuszczania. Z atomem fosforu w środku, tlenki rysują rodzaj czworościanu molekularnego.
W ten sposób kwas fosforowy można wizualizować jako czworościan. Z tej perspektywy wspomniane czworościany (w jednostkach H3PO4) oddziałują ze sobą poprzez wiązania wodorowe; to znaczy, że jego wierzchołki są bardzo zbliżone.
Te interakcje międzycząsteczkowe pozwalają kwasowi fosforowemu na krystalizację do dwóch ciał stałych: bezwodnej i półwodzianu (H3PO41 / 2HdwaO), oba z jednoskośnymi układami kryształów. Jego bezwodną postać można również opisać wzorem: 3HdwaO · PdwaLUB5, co jest równe tri-uwodnionemu pięciotlenkowi fosforu.
Czworościany mogą nawet zostać połączone kowalencyjnie, ale w tym przypadku jedna z ich jednostek musi wyeliminować cząsteczkę wody poprzez odwodnienie. Dzieje się tak, gdy H.3PO4 jest poddawany nagrzewaniu, a co za tym idzie generuje powstawanie kwasów polifosforowych (PA).
Kwas difosforowy (H.4P.dwaLUB7)
Najprostszym ze wszystkich PA jest kwas difosforowy (H.4P.dwaLUB7), znany również jako kwas pirofosforowy. Równanie chemiczne jego powstania jest następujące:
2H3PO4 <=> H.4P.dwaLUB7 + H.dwaLUB
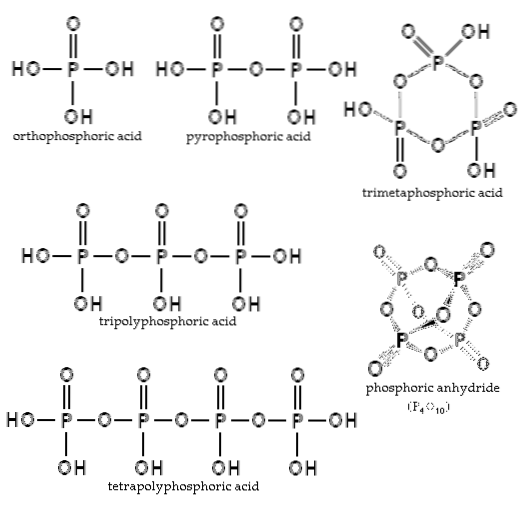
Bilans zależy od ilości wody i temperatury. Jaka jest jego struktura? Na rysunku przekroju w lewym górnym rogu zilustrowano struktury kwasu ortofosforowego i kwasu pirofosforowego..
Dwie jednostki są kowalencyjnie połączone, gdy cząsteczka wody jest eliminowana, tworząc między nimi mostek tlenowy P-O-P. Teraz nie są to trzy kwaśne wodory, ale cztery (cztery grupy -OH). Z tego powodu H.4P.dwaLUB7 ma cztery stałe jonizacji kdo.
Kwasy polifosforowe
Jeśli ogrzewanie będzie kontynuowane, może nastąpić odwodnienie przy użyciu kwasu pirofosforowego. Dlaczego? Ponieważ na każdym końcu jego cząsteczki znajduje się grupa OH, którą można usunąć jako cząsteczkę wody, co sprzyja późniejszemu wzrostowi szkieletu P-O-P-O-P ...
Przykładami takich kwasów są kwasy tripolifosforowy i tetrapolifosforowy (oba zilustrowane na obrazku). Można zobaczyć, jak kręgosłup P-O-P wydłuża się w rodzaju łańcucha złożonego z czworościanów.
Związki te można przedstawić wzorem HO (POdwaO)xH, gdzie HO to skrajna lewa, która może zostać odwodniona. POdwaOH jest szkieletem fosforowym z wiązaniami P = O i OH; a x to jednostki lub cząsteczki kwasów fosforowych niezbędne do uzyskania wspomnianego łańcucha.
Gdy związki te zostaną całkowicie zneutralizowane zasadą, powstają tzw. Polifosforany. W zależności od tego, jakie kationy je otaczają, tworzą szeroką gamę soli polifosforanowych.
Z drugiej strony, jeśli reagują z alkoholami ROH, ich wodory szkieletowe są zastępowane podstawnikami R-alkilowymi. W ten sposób powstają estry fosforanowe (lub polifosforany): RO (POdwaLUB)xR. Wystarczy zamienić H na R we wszystkich strukturach obrazu sekcji, aby je uzyskać.
Cykliczne kwasy polifosforowe
Łańcuchy P-O-P mogą nawet zamykać się na pierścieniu lub cyklu fosforowym. Najprostszym tego typu związkiem jest kwas trimetafosforowy (prawy górny róg zdjęcia). Zatem AP mogą być liniowe, cykliczne; lub jeśli ich struktury wykazują oba typy, rozgałęzione.
Nomenklatura
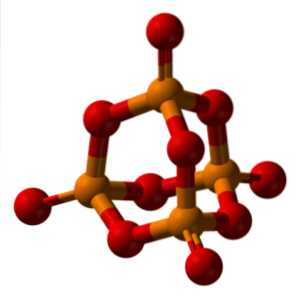
Nazewnictwo kwasu fosforowego jest podyktowane przez IUPAC i jak nazywane są trójskładnikowe sole kwasów oksokwasowych.
Ponieważ w H.3PO4 atom P ma wartościowość +5, najwyższą wartość, jego kwasowi przypisano przyrostek -ico do przedrostka fosfor-.
Orto
Jednak kwas fosforowy jest również powszechnie nazywany kwasem ortofosforowym. Dlaczego? Ponieważ słowo „orto” jest greckie i oznacza „prawda”; co przełożyłoby się na „prawdziwą formę” lub „bardziej uwodnioną” tego samego.
Kiedy bezwodny fosfor jest uwodniony nadmiarem wody (P4LUB10, „kapturek” luminoforu na powyższym obrazku) jest wytwarzany H3PO4 (3 godzdwaO · PdwaLUB5). Tak więc przedrostek orto jest przypisany do tych kwasów, które powstają z dużą ilością wody.
Pyro
Przedrostek pyro odnosi się do dowolnego związku powstającego po zastosowaniu ciepła, ponieważ kwas difosforowy powstaje w wyniku termicznego odwodnienia kwasu fosforowego. Dlatego nazywany jest kwasem pirofosforowym (2HdwaO · PdwaLUB5).
Cel
Przedrostek meta, który jest również greckim słowem, oznacza „po”. Dodawany jest do tych substancji, których formuła wyeliminowała cząsteczkę, w tym przypadku wodę:
H.3PO4 => HPO3 + H.dwaLUB
Należy zauważyć, że tym razem dodanie dwóch jednostek fosforowych nie tworzy kwasu difosforowego, ale zamiast tego otrzymuje się kwas metafosforowy (na którego istnienie nie ma dowodów).
Należy również zauważyć, że kwas ten można opisać jako HdwaO · PdwaLUB5 (podobny do hemidratu, mnożąc HPO3 Dla 2). Prefiks meta jest idealnie zgodny z cyklicznym PA, ponieważ jeśli kwas trójfosforowy odwadnia się, ale nie dodaje kolejnej jednostki H3PO4 aby stać się kwasem czterofosforowym, musi utworzyć pierścień.
Tak samo jest z innymi kwasami polimetafosforowymi, chociaż IUPAC zaleca nazywanie ich cyklicznymi związkami odpowiednich PA..
Nieruchomości
Formuła molekularna
H.3PO4
Waga molekularna
97,994 g / mol
Wygląd fizyczny
W postaci stałej przedstawia kryształy rombowe, higroskopijne i przezroczyste. W postaci płynnej jest krystaliczny z wyglądem lepkiego syropu..
Jest dostępny w handlu w postaci roztworu wodnego o stężeniu 85% w / w. We wszystkich tych prezentacjach brakuje zapachu.
Temperatury wrzenia i topnienia
158º C (316º F przy 760 mmHg).
108º F (42,2º C).
Rozpuszczalność w wodzie
548 g / 100 g H.dwaLub w 20 ° C; 369,4 g / 100 ml w 0,5 ° C; 446 g / 100 m przy 14,95 ° C.
Gęstość
1,892 g / cm3 (solidny); 1,841 g / cm3 (100% roztwór); 1,685 g / cm3 (Roztwór 85%); 1,334 g / cm3 50% roztwór) w 25 ° C.
Gęstość pary
Względem powietrza 3,4 (powietrze = 1).
Automatyczny zapłon
Nie jest łatwopalny.
Lepkość
3,86 mPoise (40% roztwór w 20 ° C).
Kwasowość
pH: 1,5 (roztwór 0,1 N w wodzie)
pKa: pKa1 = 2,148; pKa2 = 7,198 i pKa3 = 12,319. Dlatego twój najbardziej kwaśny wodór jest pierwszy.
Rozkład
Po podgrzaniu uwalnia tlenki fosforu. Jeśli temperatura wzrośnie do 213º C lub więcej, staje się kwasem pirofosforowym (H.4P.dwaLUB7).
Korozyjność
Działa korodująco na metale żelazne i aluminium. Reagowanie z tymi metalami powoduje powstanie wodoru w paliwie gazowym.
Polimeryzacja
Gwałtownie polimeryzuje ze związkami azowymi, epoksydami i związkami polimeryzowalnymi.
Aplikacje
Sole fosforanowe i zastosowania ogólne
-Kwas fosforowy służy jako podstawa do produkcji fosforanów, które są używane jako nawozy, ponieważ fosfor jest głównym składnikiem pokarmowym roślin..
-Stosowany był w leczeniu zatruć ołowiem i innych schorzeń, w których wymagane są znaczne ilości fosforanów oraz przy powstawaniu łagodnej kwasicy..
-Służy do kontrolowania pH dróg moczowych norek i wydatków w celu uniknięcia tworzenia się kamieni nerkowych.
-Kwas fosforowy tworzy sole NadwaHPO4 i NaHdwaPO4 które stanowią układ buforowy pH o pKa 6,8. Ten system regulacji pH występuje u człowieka, odgrywając ważną rolę w regulacji pH wewnątrzkomórkowego, a także w kontrolowaniu stężenia wodoru w dystalnych i zbiorczych kanalikach nefronów..
-Służy do usuwania spleśniałej warstwy tlenku żelaza, która gromadzi się na tym metalu. Kwas fosforowy tworzy fosforan żelaza, który można łatwo usunąć z powierzchni metalu. Jest również używany do elektrycznego polerowania aluminium i jest spoiwem do produktów ogniotrwałych, takich jak tlenek glinu i magnezja..
Przemysłowy
-Kwas fosforowy jest używany jako czynnik katalityczny w produkcji nylonu i benzyny. Znajduje zastosowanie jako środek odwadniający w grawerowaniu litograficznym, przy produkcji barwników stosowanych w przemyśle tekstylnym, w procesie koagulacji lateksu w przemyśle gumowym oraz przy oczyszczaniu nadtlenku wodoru.
-Kwas jest stosowany jako dodatek do napojów gazowanych, dzięki czemu wpływa na ich smak. W procesie rafinacji cukru stosuje się rozcieńczony. Pełni również funkcję układu buforowego przy przygotowywaniu szynki, żelatyny i antybiotyków..
-Bierze udział w produkcji detergentów, w katalizie kwasowej produkcji acetylenu.
-Jest stosowany jako środek zakwaszający w zbilansowanej żywności dla przemysłu hodowlanego i zwierząt domowych. Przemysł farmaceutyczny wykorzystuje go do produkcji leków przeciwwymiotnych. Jest również używany w mieszance do produkcji asfaltu do brukowania ziemi i naprawy pęknięć..
-Kwas fosforowy działa jako katalizator w reakcji hydratacji alkenów do produkcji alkoholu, głównie etanolu. Ponadto służy do oznaczania węgla organicznego w glebach.
Dentystyczny
Stosowany jest przez dentystów do czyszczenia i kondycjonowania powierzchni zębów przed założeniem aparatu ortodontycznego. Znajduje również zastosowanie w wybielaniu zębów i usuwaniu płytki nazębnej. Ponadto znajduje zastosowanie w produkcji klejów do protez dentystycznych.
Kosmetyki
Kwas fosforowy służy do regulacji pH w kosmetykach i produktach do pielęgnacji skóry. Jest stosowany jako chemiczny utleniacz do produkcji węgla aktywnego..
Tworzenie kwasu fosforowego
-Kwas fosforowy otrzymywany jest ze skał fosforanowych typu apatytu poprzez trawienie stężonym kwasem siarkowym:
AC3(PO4)dwa + 3 Hdwapołudniowy zachód4 + 6 godzdwaO => 2 godz3PO4 + 3 (CaSO4.2HdwaLUB)
Otrzymany w tej reakcji kwas fosforowy ma niską czystość, dlatego poddawany jest procesowi oczyszczania, który obejmuje wytrącanie, ekstrakcję rozpuszczalnikiem, krystalizację oraz techniki wymiany jonowej..
-Kwas fosforowy można wytwarzać rozpuszczając pięciotlenek fosforu we wrzącej wodzie.
-Można go również otrzymać ogrzewając fosfor mieszaniną powietrza i pary wodnej:
P.4 (l) + 5 Odwa (g) => P4LUB10 (s)
P.4LUB10 (s) + H.dwaO (g) => 4H3PO4 (l)
Ryzyka
-Ponieważ jego prężność par jest niska w temperaturze pokojowej, jest mało prawdopodobne, aby jego opary zostały wdychane, chyba że zostanie rozpylony kwas. Jeśli tak, objawy związane z inhalacją obejmują: kaszel, ból gardła, duszność i trudności w oddychaniu..
-W literaturze przytacza się przypadek marynarza, który był narażony na opary kwasu fosforowego przez długi czas. Cierpiał na ogólne osłabienie, suchy kaszel, ból w klatce piersiowej i problemy z oddychaniem. W ciągu roku od ekspozycji obserwowano reaktywną dysfunkcję dróg oddechowych.
-Kontakt skóry z kwasem fosforowym może powodować zaczerwienienie, ból, pęcherze i oparzenia skóry..
-Kontakt kwasu z oczami, w zależności od jego stężenia i czasu trwania kontaktu, może powodować żrące uszkodzenia tkanek lub poważne oparzenia z trwałym uszkodzeniem oczu..
-Połknięcie kwasu powoduje pieczenie jamy ustnej i gardła, uczucie pieczenia poza mostkiem, ból brzucha, wymioty, wstrząs i zapaść.
Bibliografia
- Królewskie Towarzystwo Chemii. (2015). Kwas fosforowy. Zaczerpnięte z: chemspider.com
- Kanadyjskie Centrum Bezpieczeństwa i Zdrowia w Pracy. (1999). Kwas fosforowy - skutki zdrowotne. Zaczerpnięte z: ccsso.ca
- Acids.Info. (2018). Kwas fosforowy "Różne zastosowania tego związku chemicznego. Zaczerpnięte z: acidos.info
- James P. Smith, Walter E. Brown i James R. Lehr. (1955). Struktura krystalicznego kwasu fosforowego. J. Am Chem Soc. 77,10,2728-2730
- Wikipedia. (2018). Kwasy fosforowe i fosforany. Zaczerpnięte z: en.wikipedia.org
- Nauka to zabawa. Dowiedz się o kwasie fosforowym. [PDF]. Zaczerpnięte z: scifun.chem.wisc.edu
Jeszcze bez komentarzy