
Struktura, właściwości, zastosowania i zagrożenia kwasu fumarowego

Plik Kwas fumarowy lub kwas trans-butenodiowy jest słabym kwasem dikarboksylowym, który interweniuje w cyklu Krebsa (lub cyklu kwasów trikarboksylowych) i w cyklu mocznikowym. Jego struktura molekularna to HOOCCH = CHCOOH, którego skondensowany wzór cząsteczkowy to C4H.4LUB4. Sole i estry kwasu fumarowego nazywane są fumaranami.
Jest wytwarzany w cyklu Krebsa z bursztynianu, który jest utleniany do fumaranu w wyniku działania enzymu dehydrogenazy bursztynianowej, przy użyciu FAD (Flavin Adenil Dinucleotide) jako koenzymu. Podczas gdy FAD jest zredukowany do FADHdwa. Następnie fumaran jest uwodniony do jabłczanu L przez działanie enzymu fumarazy.
W cyklu mocznikowym arginobursztynian jest przekształcany w fumaran pod działaniem enzymu liazy arginobursztynianu. Fumaran jest przekształcany w jabłczan przez fumarazę cytozolową.
Kwas fumarowy można wytwarzać z glukozy w procesie, w którym pośredniczy grzyb Rhizopus nigricans. Kwas fumarowy można również otrzymać przez kaloryczną izomeryzację kwasu maleinowego. Można go również syntetyzować przez utlenianie furfuralu chloranem sodu w obecności pięciotlenku wanadu..
Kwas fumarowy ma wiele zastosowań; jako dodatek do żywności, do produkcji żywicy oraz w leczeniu niektórych chorób, takich jak łuszczyca i stwardnienie rozsiane. Jednak stwarza niewielkie zagrożenie dla zdrowia, które należy wziąć pod uwagę..
Indeks artykułów
- 1 Struktura chemiczna
- 1.1 Izomeria geometryczna
- 2 Właściwości fizyczne i chemiczne
- 2.1 Wzór cząsteczkowy
- 2.2 Masa cząsteczkowa
- 2.3 Wygląd fizyczny
- 2.4 Zapach
- 2.5 Smak
- 2.6 Temperatura wrzenia
- 2.7 Temperatura topnienia
- 2.8 Temperatura zapłonu
- 2.9 Rozpuszczalność w wodzie
- 2.10 Rozpuszczalność w innych cieczach
- 2.11 Gęstość
- 2.12 Prężność par
- 2.13 Stabilność
- 2.14 Samozapłon
- 2.15 Ciepło spalania
- 2,16 pH
- 2.17 Rozkład
- 3 Zastosowania
- 3.1 W żywności
- 3.2 Przy produkcji żywic
- 3.3 W medycynie
- 4 Ryzyka
- 5 Referencje
Struktura chemiczna
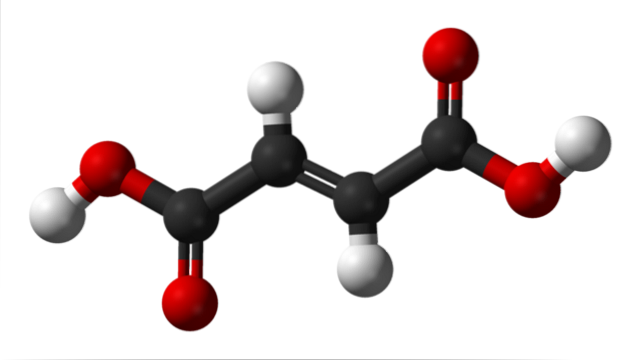
Górny obraz przedstawia strukturę molekularną kwasu fumarowego. Czarne kule odpowiadają atomom węgla, które tworzą jego hydrofobowy szkielet, podczas gdy czerwone kule należą do dwóch grup karboksylowych COOH. Zatem obie grupy COOH są oddzielone tylko dwoma atomami węgla połączonymi podwójnym wiązaniem, C = C.
Można powiedzieć, że struktura kwasu fumarowego ma geometrię liniową. Dzieje się tak, ponieważ wszystkie atomy jego szkieletu węglanowego mają hybrydyzację spdwa i dlatego spoczywają w tej samej płaszczyźnie oprócz dwóch centralnych atomów wodoru (dwie białe kule, jedna skierowana do góry, a druga skierowana w dół).
Jedynymi dwoma atomami, które wystają z tej płaszczyzny (i z kilkoma stromymi kątami), są dwa kwasowe protony grup COOH (białe kule po bokach). Gdy kwas fumarowy jest całkowicie deprotonowany, uzyskuje dwa ładunki ujemne, które rezonują na jego końcach, stając się w ten sposób anionem dwuzasadowym..
Izomeria geometryczna
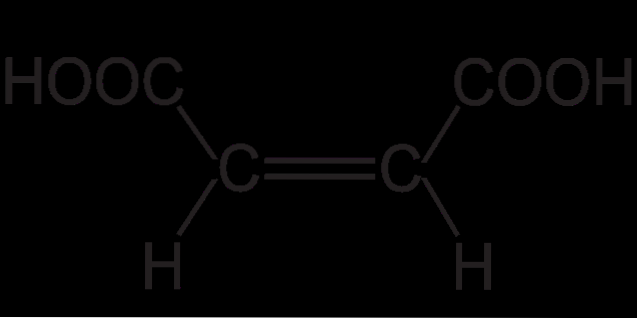
Struktura kwasu fumarowego wykazuje izomerię trans (lub E). Znajduje się to we względnych pozycjach przestrzennych podstawników na wiązaniu podwójnym. Dwa małe atomy wodoru skierowane są w przeciwnych kierunkach, podobnie jak dwie grupy COOH..
To daje kwasowi fumarowemu szkielet „zygzakowaty”. Podczas gdy inny izomer geometryczny, cis (lub Z), który jest niczym innym jak kwasem maleinowym, ma zakrzywiony szkielet w kształcie litery „C”. Ta krzywizna jest wynikiem frontalnego spotkania dwóch grup COOH i dwóch grup H w tej samej orientacji:
Fizyczne i chemiczne właściwości
Formuła molekularna
do4H.4LUB4.
Waga molekularna
116,072 g / mol.
Wygląd fizyczny
Bezbarwne krystaliczne ciało stałe. Kryształy są jednoskośne w kształcie igieł.
Biały krystaliczny proszek lub granulki.
Zapach
Toaleta.
Smak
Owoc cytrusowy.
Temperatura wrzenia
329 ° F przy ciśnieniu 1,7 mmmHg (522 ° C). Sublimuje w temperaturze 200 ° C (392 ° F) i rozkłada się w temperaturze 287 ° C.
Temperatura topnienia
572º F do 576º F (287º C).
Temperatura zapłonu
273º C (otwarta szyba). 230º C (zamknięty tygiel).
Rozpuszczalność w wodzie
7 000 mg / l przy 25ºC.
Rozpuszczalność w innych cieczach
-Rozpuszczalny w etanolu i stężonym kwasie siarkowym. Z etanolem może tworzyć wiązania wodorowe i, w przeciwieństwie do cząsteczek wody, te z etanolu oddziałują z większym powinowactwem do organicznego szkieletu jego struktury.
-Słabo rozpuszczalny w estru etylowym i acetonie.
Gęstość
1635 g / cm3 przy 68º F. 1,635 g / cm3 w 20º C.
Ciśnienie pary
1,54 x 10-4 mmHg przy 25º C.
Stabilność
Jest stabilny, chociaż ulega rozkładowi przez mikroorganizmy tlenowe i beztlenowe.
Gdy kwas fumarowy jest podgrzewany w zamkniętym pojemniku z wodą o temperaturze pomiędzy 150–170 ° C, tworzy się kwas DL-jabłkowy..
Samozapłon
1,634º F (375º C).
Ciepło spalania
2760 kcal / g.
pH
3,0-3,2 (roztwór 0,05% w 25 ° C). Wartość ta zależy od stopnia dysocjacji dwóch protonów, ponieważ jest to kwas dikarboksylowy, a zatem diprotyczny..
Rozkład
Rozkłada się podczas ogrzewania, wytwarzając gaz korozyjny. Reaguje gwałtownie z silnymi utleniaczami, tworząc łatwopalne i toksyczne gazy, które mogą spowodować pożar, a nawet wybuchy.
Przy częściowym spalaniu kwas fumarowy przekształca się w drażniący bezwodnik maleinowy..
Aplikacje
W jedzeniu
-Jest stosowany jako środek zakwaszający w żywności, pełniący funkcję regulującą kwasowość. W tym celu może również zastąpić kwas winowy i kwas cytrynowy. Ponadto jest stosowany jako środek konserwujący żywność.
-W przemyśle spożywczym kwas fumarowy jest stosowany jako środek zakwaszający, stosowany do napojów bezalkoholowych, win zachodnich, zimnych napojów, koncentratów soków owocowych, owoców w puszkach, marynat, lodów i napojów bezalkoholowych..
-Kwas fumarowy jest stosowany w codziennych napojach, takich jak mleko czekoladowe, ajerkoniak, kakao i mleko skondensowane. Kwas fumarowy jest również dodawany do serów, w tym serów topionych i substytutów sera..
-Desery takie jak budyń, jogurt smakowy i sorbety mogą zawierać kwas fumarowy. Ten kwas może konserwować jajka i desery na bazie jajek, takie jak budyń..
Dodatkowe zastosowania w przemyśle spożywczym
-Kwas fumarowy pomaga stabilizować i aromatyzować żywność. Boczek i konserwy również zawierają ten związek.
-Jego połączone zastosowanie z benzoesanami i kwasem borowym jest przydatne w zapobieganiu degradacji mięsa, ryb i skorupiaków.
-Posiada właściwości przeciwutleniające, dlatego był używany do konserwacji masła, serów i mleka w proszku..
-Ułatwia obróbkę ciasta mącznego, ułatwiając jego obróbkę.
-Z powodzeniem stosowany w diecie świń w zakresie przyrostu masy ciała, poprawy czynności trawiennych oraz redukcji bakterii chorobotwórczych w układzie pokarmowym..
W produkcji żywic
-Kwas fumarowy stosowany jest do produkcji nienasyconych żywic poliestrowych. Ta żywica ma doskonałą odporność na korozję chemiczną i odporność na ciepło. Dodatkowo znajduje zastosowanie w produkcji żywic alkidowych, żywic fenolowych oraz elastomerów (kauczuków).
-Kopolimer kwasu fumarowego / octanu winylu to wysokiej jakości klej. Kopolimer kwasu fumarowego ze styrenem jest surowcem do produkcji włókien szklanych.
-Stosowany był do produkcji alkoholi wielowodorotlenowych oraz jako zaprawa barwników.
W medycynie
-Fumaran sodu może reagować z siarczanem żelazawym, tworząc żel fumaranowy żelaza, dając początek lekowi o nazwie Fersamal. Jest to również stosowane w leczeniu niedokrwistości u dzieci.
-Ester fumaran dimetylu jest stosowany w leczeniu stwardnienia rozsianego, powodując w ten sposób zmniejszenie postępu niepełnosprawności.
-W leczeniu łuszczycy stosowano różne estry kwasu fumarowego. Związki kwasu fumarowego wywierałyby swoje działanie terapeutyczne poprzez swoje właściwości immunomodulacyjne i immunosupresyjne..
-Roślina Fumaria officinalis zawiera naturalnie kwas fumarowy i jest stosowana od dziesięcioleci w leczeniu łuszczycy.
Jednak u pacjenta leczonego kwasem fumarowym z powodu łuszczycy obserwowano niewydolność nerek, zaburzenia czynności wątroby, objawy żołądkowo-jelitowe i uderzenia gorąca. Zaburzenie zostało zdiagnozowane jako ostra martwica cewek kanalikowych.
Eksperymenty z tym związkiem
-W eksperymencie na ludziach, którym podawano 8 mg kwasu fumarowego dziennie przez rok, żaden z uczestników nie wykazał uszkodzenia wątroby.
-Kwas fumarowy był stosowany do hamowania nowotworów wątroby wywołanych tiocetamidem u myszy..
-Został zastosowany u myszy leczonych mitomycyną C. Lek ten powoduje zaburzenia czynności wątroby, na które składają się różne zmiany cytologiczne, takie jak nieregularność okołojądrowa, agregacja chromatyny i nieprawidłowe organelle cytoplazmatyczne. Również kwas fumarowy zmniejsza częstość występowania tych zmian.
-W doświadczeniach na szczurach kwas fumarowy wykazał zdolność hamowania rozwoju brodawczaka przełyku, glejaka mózgu oraz guzów mezenchymalnych nerek..
-Istnieją eksperymenty, które pokazują odwrotny wpływ kwasu fumarowego w stosunku do guzów nowotworowych. Niedawno zidentyfikowano go jako onkometabolit lub endogenny metabolit, który może powodować raka. W guzach i płynie wokół guza występuje wysoki poziom kwasu fumarowego.
Ryzyka
-W kontakcie z oczami proszek kwasu fumarowego może powodować podrażnienie objawiające się zaczerwienieniem, łzawieniem i bólem.
-W kontakcie ze skórą może powodować podrażnienia i zaczerwienienia.
-Wdychanie może podrażniać błonę śluzową nosa, krtani i gardła. Może również powodować kaszel lub duszność..
-Z drugiej strony, kwas fumarowy nie wykazuje toksyczności po spożyciu..
Bibliografia
- Steven A. Hardinger. (2017). Ilustrowany słownik chemii organicznej: kwas fumarowy. Zaczerpnięte z: chem.ucla.edu
- Grupa Transmerquim. (Sierpień 2014). Kwas fumarowy. [PDF]. Zaczerpnięte z: gtm.net
- Wikipedia. (2018). Kwas fumarowy. Zaczerpnięte z: en.wikipedia.org/wiki/Fumaric_acid
- PubChem. (2018). Kwas fumarowy. Zaczerpnięte z: pubchem.ncbi.nlm.nih.gov
- Królewskie Towarzystwo Chemii. (2015). Kwas fumarowy. Zaczerpnięte z: chemspider.com
- ChemicalBook. (2017). Kwas fumarowy. Zaczerpnięte z: chemicalbook.com



Jeszcze bez komentarzy