
Mocne i słabe kwasy i zasady

Klasyfikacja kwasów i zasad w chemii zależy od siły jonizacji tych substancji w środowisku wodnym. A) Tak:
- za kwas i zasada są mocne gdy są całkowicie zjonizowane, czyli w procesie jonizacji ulegają całkowitej przemianie na kationy lub jony dodatnie oraz w aniony lub jony ujemne.
- Z drugiej strony, kwas i zasada są słabe gdy są częściowo zjonizowane w wodzie, to znaczy w roztworze będzie pewna część kationów, inna proporcja anionów i inna część niezdysocjowanych cząsteczek.
| Mocne kwasy i zasady | Słabe kwasy i zasady | |
|---|---|---|
| Definicja | Substancje, które całkowicie jonizują w roztworze. | Substancje, które częściowo jonizują w roztworze. |
| Jonizacja | Kompletny | Częściowy |
| Pierwiastki w roztworze wodnym | Kationy i aniony w tym samym stężeniu. | Kationy, aniony i cząsteczki w różnych proporcjach. |
| Stała jonizacji | Podniesiony | Mało |
| Przykłady |
|
|
Mocne kwasy i zasady
ZA Kwas lub zasada są mocne, gdy w środowisku wodnym ulegają całkowitej dysocjacji, to znaczy proces jonizacji jest zakończony i roztwór będzie miał takie samo stężenie anionów jak kationy.
Jak jonizujesz kwas i mocną zasadę??
Silny kwas, taki jak kwas solny HCl, jonizuje w następujący sposób:
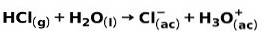
Mocna zasada, taka jak wodorotlenek sodu NaOH, jonizuje w następujący sposób:
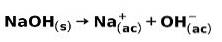
Przykłady mocnych kwasów i ich receptury
| Mocne kwasy | Formuła |
|---|---|
| Kwas chlorowodorowy | HCl |
| Kwas Siarkowy | H.dwapołudniowy zachód4 |
| Kwas azotowy | HNO3 |
| Kwas bromowodorowy | HBr |
| Kwas nadchlorowy | HClO4 |
| Kwas chromowy | H.dwaCrO4 |
| Kwas tetrafluroborowy | HBF4 |
Przykłady mocnych zasad i ich formuły
| Mocna podstawa | Formuła |
|---|---|
| Wodorotlenek sodu | NaOH |
| Wodorotlenek litu | LiOH |
| Wodorotlenek potasu | KOH |
| Wodorotlenek rubidu | RbOH |
| Wodorotlenek cezu | CsOH |
| Wodorotlenek wapnia | Ca (OH)dwa |
| Wodorotlenek baru | Ba (OH)dwa |
| Wodorotlenek strontu | Sr (OH)dwa |
| Wodorotlenek glinu | Al (OH)3 |
Możesz być zainteresowany, aby zobaczyć więcej przykładów kwasów i zasad.
Słabe kwasy i zasady
ZA Kwas lub zasada są słabe, gdy są częściowo zjonizowane w roztworze wodnym, to znaczy w roztworze znajdują się jony i niezjonizowane cząsteczki.
Jak jonizujesz kwas i słabą zasadę??
Słaby kwas, taki jak kwas octowy CH3COOH jest jonizowany w następujący sposób:
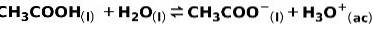
Równowagę tej reakcji wyrażają dwie strzałki w przeciwnych kierunkach.
Kiedy słaby kwas dysocjuje lub jonizuje, ustala się równowaga między związkami obecnymi w roztworze; można to wyrazić za pomocą a stała jonizacji kwaśny:
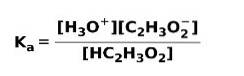
Stała jonizacji to nic innego jak stosunek pomiędzy zwielokrotnieniem stężenia produktów przez zwielokrotnienie stężenia reagentów.
Słaba zasada, taka jak amoniak NH3, jonizuje w następujący sposób:
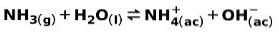
Gdy słaba zasada dysocjuje lub jonizuje, ustala się równowaga między związkami obecnymi w roztworze; można to wyrazić za pomocą a zasadowa stała jonizacji:
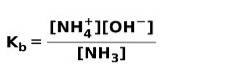
Możesz być zainteresowany poznaniem różnicy między kwasami a zasadami.
Przykłady słabych kwasów wraz z ich formułą i stałą jonizacji kwasowej Kdo
| Słaby kwas | Formuła | Stała jonizacji |
|---|---|---|
| Kwas mrówkowy | H.dwaWSPÓŁdwa | 1,77 x 10-4 |
| Kwas octowy | H.3CCOH | 1,75 x 10-5 |
| Kwas cyjanowodorowy | HOCN | 3,30 x 10-4 |
| Cyjanowodór | HCN | 6,20 x 10-10 |
| Kwas podchlorawy | HOCl | 3,50 x 10-8 |
| Kwas azotowy | HNOdwa | 4,00 x 10-4 |
| Kwas mlekowy | HC3H.5LUB3 | 1,40 x 10-4 |
| Kwas węglowy | H.dwaWSPÓŁ3 | 4,30 x 10-7 5,60 x 10-jedenaście |
| Kwas borowy | H.3BO3 | 5,80 x 10-10 1,80 x 10-13 3,00 x 10-14 |
Przykłady słabych zasad wraz z ich wzorem i podstawową stałą jonizacji Kb
| Słaba podstawa | Formuła | Stała jonizacji |
|---|---|---|
| Amoniak | NH3 | 1,75 x 10-5 |
| Metyloamina | CH3NHdwa | 4,38 x 10-4 |
| Etyloamina | dodwaH.5NHdwa | 5,60 x 10-4 |
| Anilina | do6H.5NHdwa | 3,80 x 10-10 |
| Pirydyna | do5H.5N | 1,70 x 10-9 |
| Benzylamina | do7H.9N | 2,20 x 10-5 |
| Wodorowęglan sodu | NaHCO | 2,00 x 10-4 |
Możesz chcieć dowiedzieć się więcej o charakterystyce kwasów i zasad



Jeszcze bez komentarzy