
Budowa, funkcje, inhibitory oksydazy cytochromu c
Plik oksydaza cytochromu c Jest to kompleks białek enzymatycznych, które mogą przenikać przez dwuwarstwę lipidową błony komórkowej. Jest rozpuszczalny w krwi i jest związany głównie z wewnętrzną błoną mitochondriów, znajdując się zarówno w organizmach prokariotycznych (bakteriach), jak i eukariotach (jednokomórkowych i wielokomórkowych)..
Enzym ten, zwany również kompleksem IV, jest niezbędny w tlenowych funkcjach metabolicznych organizmów, ponieważ jest niezbędny w łańcuchu transportu elektronów, w którym komórka spala cukry i wychwytuje część energii uwalnianej do przechowywania trifosforanu adenozyny lub ATP..
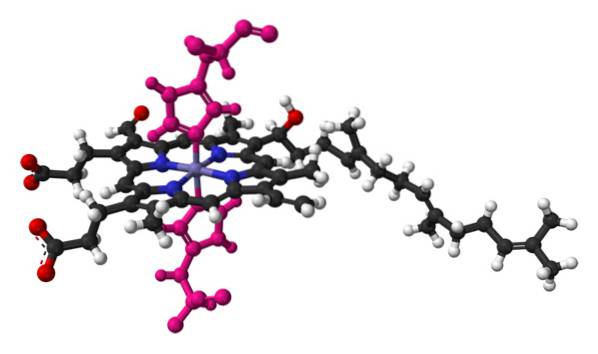
Nazwa cytochrom oznacza „pigmenty komórkowe”. To są białka krwi, które przenoszą elektrony. Cytochromy zostały odkryte przez irlandzkiego lekarza Charlesa Alexandra MacMunna w 1884 roku. MacMunn był pionierem w odkryciu barwnika oddechowego we krwi, zwanego dziś cytochromem 1..
W latach dwudziestych rosyjski entomolog i parazytolog David Keilin na nowo odkrył i scharakteryzował pigmenty oddechowe i był tym, który nazwał je cytochromami. Chociaż MacMunn odkrył je w 1884 roku, społeczność naukowa zapomniała o nim, a niektórzy nawet błędnie zinterpretowali jego pracę..
Indeks artykułów
- 1 Charakterystyka ogólna
- 1,1 -Cytochrom c
- 2 Oksydaza cytochromu c lub kompleks IV
- 3 Struktura
- 4 Funkcje
- 4.1 Apoptoza lub zaprogramowana śmierć komórki
- 4.2 Regeneracja komórek lub tkanek
- 4.3 Metabolizm energetyczny
- 5 Inhibitorów
- 6 Niedobór
- 7 Zastosowania w filogenezie
- 8 Odniesienia
Ogólna charakterystyka
Ogólnie pigmenty oddechowe mają charakterystyczne widma światła widzialnego. Wiadomo, że istnieją co najmniej cztery integralne kompleksy białek błonowych, w których występuje 5 różnych typów cytochromów: a, a3, b, c1 i c, sklasyfikowanych według długości fal widmowych maksimów absorpcji.
Zwykle znajdują się na wewnętrznej błonie mitochondriów. Jednak obserwowano je również w siateczce endoplazmatycznej i chloroplastach, u organizmów eukariotycznych i prokariotycznych..
Przedstawiają grupę protetyczną hemu zawierającą żelazo (Fe). Każdy ze znanych cytochromów działa w kompleksach wieloenzymatycznych w transporcie elektronów w procesie lub łańcuchu oddechowym..
Cytochromy pełnią funkcję uczestniczenia w reakcjach utleniania-redukcji. Reakcje redukcji, w których przyjmują elektrony, zachodzą różnie dla każdego typu cytochromu, a ich wartość jest określana przez przepływ elektronów z łańcucha oddechowego.
-Cytochrom c
Znane są cztery klasy cytochromu c, które są następujące.
Klasa I
W tej klasie znajdują się rozpuszczalne cytochromy c (lowspin) o niskim spinie, obecne w bakteriach i mitochondriach. Są ośmiościenne. Miejsce wiązania hemu znajduje się na N-końcu histydyny, a szósty ligand jest dostarczany przez resztę metioniny na C-końcu..
Z tej klasy można nawet rozpoznać kilka podklas, których trójwymiarowa struktura została określona..
Klasa II
W tej klasie znajdują się cytochromy o wysokim spinie c i niektóre cytochromy o niskim spinie c. Te wysokoobrotowe mają miejsce wiązania blisko C-końca, aw przypadku niskoobrotowych szósty ligand wydaje się być resztą metioniny w pobliżu N-końca. Są one pentakoordynowane z histydyną piątego liganda.
Klasa III
Ta klasa charakteryzuje się prezentacją cytochromów c z wieloma hemami (c3 i c7) i niskim potencjałem redukcji tlenków, przy zaledwie 30 resztach aminokwasowych na grupę hemu. W przedstawicielach tej klasy grupy hemowe oprócz prezentowania różnych potencjałów redoks mają nierównomierną budowę i funkcje. Są ośmiościenne.
Klasa IV
Według niektórych autorów ta klasa została stworzona wyłącznie po to, aby uwzględnić złożone białka obecne w innych grupach protetycznych, a także m.in.hem c czy flawocytochrom c..
Oksydaza cytochromu c lub kompleks IV
Oksydaza cytochromu c jest enzymem mitochondrialnym, który przeprowadza ostatnią fazę transportu elektronów w oddychaniu komórkowym. Enzym ten katalizuje transport elektronów ze zredukowanego cytochromu c do tlenu..
Niektóre związki chemiczne, takie jak cyjanek, dwutlenek węgla i azydek, mogą hamować działanie tego enzymu, powodując tzw. Komórkową asfiksję chemiczną. Innymi formami hamowania kompleksu IV są mutacje genetyczne.
Z ewolucyjnego punktu widzenia oksydaza cytochromu c występuje tylko w organizmach tlenowych, a kilka grup naukowców sugeruje, że obecność tego białka wskazuje na pokrewieństwo ewolucyjne, w którym rośliny, grzyby, a także zwierzęta mają wspólnego przodka..
Struktura
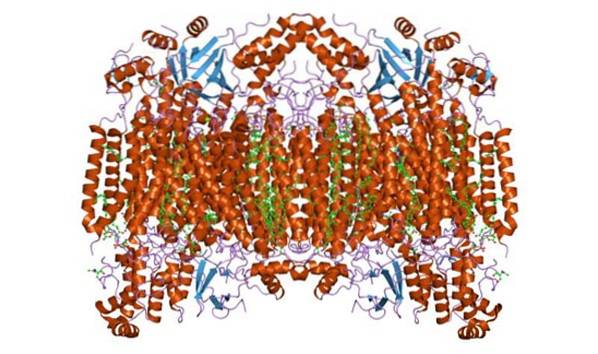
Oksydaza cytochromu c tworzy homodimeryczny kompleks, to znaczy złożony z dwóch podobnych monomerów w wewnętrznej błonie mitochondriów. Kompleks enzymatyczny składa się z 3 do 4 podjednostek w organizmach prokariotycznych i maksymalnie 13 (niektórzy sugerują 14) polipeptydów w organizmach, takich jak ssaki..
U tych organizmów 3 polipeptydy są pochodzenia mitochondrialnego, a reszta pochodzi z jądra. Każdy monomer ma 28 transbłonowych helis, które oddzielają domeny hydrofilowe od matrycy błony i przestrzeni międzybłonowej..
Ma pojedynczą jednostkę katalityczną, którą można znaleźć we wszystkich enzymach katalizujących reakcje utleniania / redukcji przy użyciu tlenu cząsteczkowego (oksydazy, zwłaszcza miedzi hemowej). Kompleks zawiera cytochromy a i a3 połączone przez podjednostkę I i dwa centra miedzi.
Ma jedną lub więcej grup hemowych C połączonych z otaczającą strukturą białka jednym lub większą liczbą (zazwyczaj dwoma) wiązaniami tioeterowymi. Inni autorzy sugerują, że istnieje pojedyncza grupa hemu C kowalencyjnie związana z białkiem między pierścieniem porfiryny a dwiema resztami cysteiny..
Jedyna grupa hemowa wspomniana powyżej jest otoczona resztami hydrofobowymi i jest hekskoordynowana, z histydyną w pozycji 18 łańcucha polipeptydowego i metioniną w pozycji 80..
funkcje
Oksydazy cytochromu c są protagonistami trzech głównych mechanizmów fizjologicznych, które zobaczymy poniżej.
Apoptoza lub zaprogramowana śmierć komórki
Apoptoza to programowane zniszczenie lub śmierć komórki, wywołane przez sam organizm, którego celem jest kontrola wzrostu, rozwoju, eliminacja uszkodzonych tkanek i regulacja układu odpornościowego. W tym fizjologicznym procesie oksydaza cytochromu c uczestniczy jako półprodukt.
Białko to, uwalniane przez mitochondria, prowadzi do interakcji z retikulum endoplazmatycznym, co powoduje wydzielanie lub uwalnianie wapnia. Postępujący wzrost poziomu wapnia wyzwala masowe uwalnianie oksydazy cytochromu c, aż do osiągnięcia cytotoksycznego poziomu wapnia..
Cytotoksyczny poziom wapnia i uwolnienie cytochromów c powodują kaskadową aktywację kilku enzymów kaspazy, które są odpowiedzialne za niszczenie komórek.
Regeneracja komórek lub tkanek
Kilka badań wskazuje, że gdy oksydaza cytochromu c jest wystawiona na działanie fal o długości 670 nanometrów, uczestniczy w funkcjonalnym kompleksie, który penetruje uszkodzoną lub uszkodzoną tkankę i zwiększa szybkość regeneracji komórek..
Metabolizm energetyczny
Jest to prawdopodobnie najlepiej znana i najważniejsza funkcja oksydazy cytochromu c. To właśnie kompleks oksydazy (łańcucha oddechowego) jest odpowiedzialny za zbieranie elektronów z cytochromu c i przekazywanie ich do cząsteczki tlenu, redukując ją do dwóch cząsteczek wody..
W połączeniu z tym procesem, translokacja protonów zachodzi przez błonę, powodując wytworzenie gradientu elektrochemicznego, który kompleks syntetazy ATP wykorzystuje do produkcji lub syntezy ATP (trifosforan adenozyny)..
Inhibitory
Oksydaza cytochromu c jest hamowana przez różne związki i procesy chemiczne. Sposób, w jaki zachodzi, może wynikać z naturalnego sposobu regulowania produkcji lub działania enzymu lub może wystąpić przypadkowo w wyniku zatrucia..
W obecności azydku, cyjanku lub tlenku węgla wiąże się z nimi oksydaza cytochromu c, co hamuje działanie kompleksu białkowego. Powoduje to przerwanie procesu oddychania komórkowego, a tym samym powoduje chemiczne uduszenie komórek..
Inne związki, takie jak tlenek azotu, siarkowodór, metanol i niektóre metylowane alkohole, również powodują hamowanie oksydazy cytochromu c..
Niedobór
Oksydaza cytochromu c jest enzymem kontrolowanym przez geny w jądrze i mitochondriach. Istnieją zmiany lub mutacje genetyczne, które mogą prowadzić do niedoboru oksydazy cytochromu c.
Mutacje te zaburzają funkcjonalność enzymu, ponieważ zmieniają jego strukturę enzymatyczną, niosąc ze sobą zaburzenia metaboliczne w trakcie rozwoju embrionalnego (według badań na ludziach), które będą miały później wpływ na organizm w pierwszych latach jego życia..
Niedobór oksydazy cytochromu c wpływa na tkanki o dużym zapotrzebowaniu na energię, takie jak serce, wątroba, mózg i mięśnie. Objawy tych mutacji pojawiają się przed upływem dwóch lat życia i mogą objawiać się silnymi lub łagodnymi stanami.
Łagodne objawy można zauważyć już wkrótce po pierwszym roku życia, a osoby z nimi zwykle mają jedynie obniżone napięcie mięśni (hipotonia) i zanik mięśni (miopatia)..
Z drugiej strony osoby z silniejszymi objawami mogą mieć zanik mięśni i encefalomiopatię. Inne stany spowodowane brakiem oksydazy cytochromu c to kardiomiopatia przerostowa, patologiczne powiększenie wątroby, zespół Leigha i kwasica mleczanowa..
Zastosowania w filogenezie
Filogeneza jest nauką odpowiedzialną za badania pochodzenia, formowania i ewolucyjnego rozwoju organizmów z punktu widzenia przodków i potomków. W ostatnich dziesięcioleciach badania filogenezy z analizą molekularną były coraz częstsze, dostarczając wielu informacji i rozwiązując problemy taksonomiczne..
W tym sensie niektóre badania filogenetyczne wskazują, że użycie oksydaz cytochromu c może pomóc w ustanowieniu relacji ewolucyjnych. Dzieje się tak, ponieważ ten kompleks białkowy jest wysoce konserwatywny i występuje w wielu różnych organizmach, od jednokomórkowych protistów po duże kręgowce..
Przykładem tego są testy przeprowadzone na ludziach, szympansach (Chleb Paniscus) i makaki rezusowe (Macaca mulatta). Takie testy wykazały, że cząsteczki oksydazy cytochromu c człowieka i szympansa były identyczne..
Wykazano również, że cząsteczki oksydazy cytochromu c makaka rezus różniły się o jeden aminokwas od tych z pierwszych dwóch, co w konsekwencji potwierdza pokrewieństwo przodek-potomek między szympansami a ludźmi..
Bibliografia
- R.P. Ambler (1991). Zmienność sekwencji w cytochromach bakteryjnych c. Biochimica et Biophysica Acta (BBA) - Bioenergetyka.
- Cytochrom c. Odzyskany z newworldencyclopedia.org.
- V. Colman, E. Costa, R. Chaves, V. Tórtora (2015). Biologiczne role cytochromu c: mitochondrialny transport elektronów, programowana śmierć komórki i wzrost aktywności nadtlenkowej. Roczniki Wydziału Lekarskiego.
- Podjednostka oksydazy cytochromu c I. Odzyskana z ebi.ac.uk.
- L. Youfen, P. Jeong-Soon, D. Jian-Hong i B. Yidong (2007). Podjednostka IV oksydazy cytochromu c jest niezbędna do tworzenia i funkcjonowania kompleksu enzymatycznego w układzie oddechowym. Journal of Bioenergetics and Biomembranes.
- Grupa genów: kompleks mitochondrialny IV: podjednostki oksydazy cytochromu c (COX, MT-CO). Odzyskany z genenames.org.
- E.F. Hartree (1973). Odkrycie cytochromu. Edukacja biochemiczna.
- Oksydaza cytochromu c, niedobór…. Odzyskany z ivami.com.
- C.K. Mathews, K.E. van Holde & K.G. Ahern (2002). Biochemestry. III edycja. Wydawnictwo Benjamin / Cummings, Inc..



Jeszcze bez komentarzy