
Historia, właściwości, struktura, zagrożenia, zastosowania chloru
Plik chlor Jest to pierwiastek chemiczny reprezentowany przez symbol Cl. Jest to drugi z halogenów, znajdujący się poniżej fluoru, a także trzeci najbardziej elektroujemny pierwiastek ze wszystkich. Jego nazwa wywodzi się od żółtawozielonego koloru, który jest bardziej intensywny niż fluor.
Powszechnie, gdy ktoś słyszy twoje imię, pierwszą rzeczą, o której przychodzi mu do głowy, są produkty do wybielania ubrań i woda w basenach. Chociaż chlor działa skutecznie w takich przykładach, to nie jego gaz, ale jego związki (zwłaszcza podchloryn) wywierają działanie wybielające i dezynfekujące..

Powyższy obrazek przedstawia okrągłą kolbę z gazowym chlorem. Jego gęstość jest większa niż powietrza, co wyjaśnia, dlaczego pozostaje w kolbie i nie ucieka do atmosfery; tak jak to ma miejsce w przypadku innych lżejszych gazów, na przykład helu lub azotu. W tym stanie jest substancją silnie toksyczną, ponieważ w płucach wytwarza kwas solny..
Dlatego chlor elementarny lub gazowy nie ma wielu zastosowań poza niektórymi syntezami. Jednak jego związki, czy to sole, czy chlorowane cząsteczki organiczne, obejmują szeroki wachlarz zastosowań, wykraczając poza baseny i wyjątkowo białą odzież..
Podobnie jego atomy w postaci anionów chlorkowych znajdują się w naszym organizmie, regulując poziom sodu, wapnia i potasu, a także w soku żołądkowym. W przeciwnym razie spożycie chlorku sodu byłoby jeszcze bardziej śmiertelne.
Chlor jest wytwarzany przez elektrolizę solanki bogatej w chlorek sodu, proces przemysłowy, w którym otrzymuje się również wodorotlenek sodu i wodór. A ponieważ morza są prawie niewyczerpanym źródłem tej soli, potencjalne rezerwy tego pierwiastka w hydrosferze są bardzo duże..
Indeks artykułów
- 1 Historia
- 1.1 Pierwsze podejścia
- 1.2 Odkrycie
- 1.3 Kwas oksymurowy
- 1.4 Uznanie jako element
- 2 Właściwości fizyczne i chemiczne
- 2.1 Wygląd fizyczny
- 2.2 Liczba atomowa (Z)
- 2.3 Masa atomowa
- 2.4 Temperatura wrzenia
- 2.5 Temperatura topnienia
- 2.6 Gęstość
- 2.7 Ciepło topnienia
- 2.8 Ciepło parowania
- 2,9 Molowa pojemność cieplna
- 2.10 Rozpuszczalność w wodzie
- 2.11 Prężność par
- 2.12 Elektroujemność
- 2.13 Energie jonizacji
- 2.14 Przewodność cieplna
- 2.15 Izotopy
- 2.16 stopni utlenienia
- 3 Struktura i konfiguracja elektroniczna
- 3.1 Cząsteczka chloru
- 3.2 Oddziaływania międzycząsteczkowe
- 4 Gdzie znaleźć i otrzymać
- 4.1 Sole chlorkowe
- 4.2 Elektroliza solanki
- 4.3 Rozpuszczanie piroluzytu w kwasie
- 5 stopów
- 6 Ryzyka
- 7 zastosowań
- 7.1 Synteza
- 7.2 Biologiczne
- 7.3 Broń chemiczna
- 7.4 Środek dezynfekujący
- 7.5 Wybielacz
- 7.6 Polichlorek winylu
- 8 Odniesienia
Fabuła
Pierwsze podejścia
Ze względu na wysoką reaktywność chloru gazowego starożytne cywilizacje nigdy nie podejrzewały jego istnienia. Jednak jego związki były częścią kultury ludzkości od czasów starożytnych; jego historia zaczęła się od soli kuchennej.
Z drugiej strony chlor powstał w wyniku erupcji wulkanów i kiedy ktoś rozpuścił złoto w wodzie królewskiej; Ale żadne z tych pierwszych podejść nie wystarczyło nawet do sformułowania idei, że wspomniany żółtawo-zielony gaz jest pierwiastkiem lub związkiem.
Odkrycie
Odkrycie chloru przypisuje się szwedzkiemu chemikowi Carlowi Wilhelmowi Scheele, który w 1774 roku przeprowadził reakcję między mineralnym piroluzytem a kwasem solnym (zwanym wówczas kwasem muriatowym).
Scheele zyskuje uznanie, ponieważ był pierwszym naukowcem, który zbadał właściwości chloru; chociaż wcześniej rozpoznany (1630) przez Jana Baptist van Helmont.
Ciekawe są eksperymenty, za pomocą których Scheele uzyskał swoje obserwacje: ocenił wybielające działanie chloru na czerwonawe i niebieskawe płatki kwiatów, a także na liściach roślin i owadów, które natychmiast obumarły..
Podobnie, donosił, że jest silnie reagujący na metale, duszący zapach i niepożądany wpływ na płuca, a po rozpuszczeniu w wodzie jego kwasowość wzrosła..
Kwas oksymurowy
Do tego czasu chemicy uważali każdy związek zawierający tlen za kwas; więc błędnie myśleli, że chlor musi być gazowym tlenkiem. Tak nazwali go `` kwasem oksymurowym '' (tlenkiem kwasu muriatowego), nazwa wymyślona przez słynnego francuskiego chemika Antoine'a Lavoisiera.
Następnie w 1809 roku Joseph Louis Gay-Lussac i Louis Jacques Thénard próbowali zredukować ten kwas węglem drzewnym; reakcja, w której otrzymali metale z ich tlenków. W ten sposób chcieli wydobyć pierwiastek chemiczny z rzekomego kwasu oksymurowego (który nazwali `` powietrzem deflogsticowanym kwasem muriatowym ''.
Jednak eksperymenty Gay-Lussaca i Thénarda nie powiodły się; ale mieli rację rozważając możliwość, że wspomniany żółtawozielony gaz musi być pierwiastkiem chemicznym, a nie związkiem.
Uznanie jako element
Uznanie chloru za pierwiastek chemiczny zawdzięczamy Sir Humphry'emu Davy'emu, który w 1810 roku przeprowadził własne eksperymenty z elektrodami węglowymi i doszedł do wniosku, że taki tlenek kwasu solnego nie istnieje..
Co więcej, to Davy ukuł nazwę „chlor” dla tego pierwiastka od greckiego słowa „chloros”, które oznacza żółtawo-zielony..
Gdy badali właściwości chemiczne chloru, okazało się, że wiele jego związków ma naturę zasoloną; dlatego nazwali go „halogenem”, co oznacza solistą. Następnie termin halogen został użyty z innymi pierwiastkami z tej samej grupy (F, Br i I).
Michael Faraday zdołał nawet skroplić chlor w substancję stałą, która z powodu zanieczyszczenia wodą utworzyła hydrat CldwaH.dwaLUB.
Reszta historii chloru związana jest z jego właściwościami dezynfekującymi i wybielającymi, aż do rozwoju przemysłowego procesu elektrolizy solanki w celu produkcji ogromnych ilości chloru..
Fizyczne i chemiczne właściwości
Wygląd fizyczny
Jest to gęsty, nieprzejrzysty, żółtawozielony gaz o drażniącym, gryzącym zapachu (bardzo wzmocniona wersja dostępnego w handlu chloru), a także niezwykle trujący..
Liczba atomowa (Z)
17
Masa atomowa
35.45 u.
O ile nie zaznaczono inaczej, wszystkie inne właściwości odpowiadają wielkościom zmierzonym dla chloru cząsteczkowego, Cldwa.
Temperatura wrzenia
-34,04 ºC
Temperatura topnienia
-101,5 ºC
Gęstość
-W normalnych warunkach 3,2 g / l
-W temperaturze wrzenia 1,5624 g / ml
Zauważ, że ciekły chlor jest około pięć razy gęstszy niż jego gaz. Ponadto gęstość jego oparów jest 2,49 razy większa niż powietrza. Dlatego na pierwszym zdjęciu chlor nie ma tendencji do ucieczki z kolby okrągłej, ponieważ jest gęstszy od powietrza, znajduje się na dnie. Ta cecha czyni go jeszcze bardziej niebezpiecznym gazem..
Ciepło topnienia
6,406 kJ / mol
Ciepło parowania
20,41 kJ / mol
Molowa pojemność cieplna
33,95 J / (mol K)
Rozpuszczalność w wodzie
1,46 g / 100 ml w 0 ºC
Ciśnienie pary
7,67 atm w 25 ° C To ciśnienie jest stosunkowo niskie w porównaniu z innymi gazami.
Elektroujemność
3.16 w skali Paulinga.
Energie jonizacji
-Pierwsza: 1251,2 kJ / mol
-Po drugie: 2298 kJ / mol
-Po trzecie: 3822 kJ / mol
Przewodność cieplna
8,9 10-3 W / (mK)
Izotopy
Chlor występuje w przyrodzie głównie jako dwa izotopy: 35Cl, z zawartością 76% i 37Cl, z obfitością 24%. Zatem masa atomowa (35,45 u) jest średnią mas atomowych tych dwóch izotopów, wraz z ich odpowiednimi procentami zawartości..
Wszystkie radioizotopy chloru są sztuczne, w tym 36Cl jako najbardziej stabilny, z okresem półtrwania 300 000 lat.
Liczby utleniania
Chlor może mieć różne stopnie lub stopnie utlenienia, gdy jest częścią związku. Będąc jednym z najbardziej elektroujemnych atomów w układzie okresowym, zwykle ma ujemne stopnie utlenienia; chyba że natrafi na tlen lub fluor, w których odpowiednio tlenkach i fluorkach musi „stracić” elektrony.
W ich stopniach utlenienia zakłada się istnienie lub obecność jonów o tej samej wielkości ładunku. Mamy więc: -1 (Cl-, słynny anion chlorkowy), +1 (Cl+), +2 (Cldwa+), +3 (Cl3+), +4 (Cl4+), +5 (Cl5+), +6 (Cl6+) i +7 (kl7+). Spośród nich -1, +1, +3, +5 i +7 są najczęściej spotykane w związkach chlorowanych..
Na przykład w ClF i ClF3 stopnie utlenienia chloru wynoszą +1 (Cl+fa-) i +3 (Cl3+fa3-). W CldwaLub to jest +1 (Cldwa+LUBdwa-); będąc w ClOdwa, CldwaLUB3 i CldwaLUB7, wynosi +4 (Cl4+LUBdwadwa-), +3 (Cldwa3+LUB3dwa-) i +7 (kldwa7+LUB7dwa-).
Z drugiej strony, we wszystkich chlorkach stopień utlenienia chloru wynosi -1; jak w przypadku NaCl (Na+Cl-), gdzie można powiedzieć, że Cl istnieje- biorąc pod uwagę jonowy charakter tej soli.
Struktura i konfiguracja elektroniczna
Cząsteczka chloru

Atomy chloru w stanie podstawowym mają następującą konfigurację elektroniczną:
[Ne] 3sdwa 3p5
Dlatego każdy z nich ma siedem elektronów walencyjnych. O ile nie są przeładowane energią, w przestrzeni będą znajdować się pojedyncze atomy Cl, jak zielone kulki. Jednak ich naturalną tendencją jest tworzenie między nimi wiązań kowalencyjnych w celu uzupełnienia ich oktetów walencyjnych..
Zauważ, że prawie nie potrzebują jednego elektronu, aby mieć osiem elektronów walencyjnych, więc tworzą pojedyncze proste wiązanie; to jest ten, który łączy dwa atomy Cl, tworząc cząsteczkę Cldwa (górne zdjęcie), Cl-Cl. Dlatego chlor w normalnych i / lub ziemskich warunkach jest gazem molekularnym; nie jednoatomowy, jak w przypadku gazów szlachetnych.
Oddziaływania międzycząsteczkowe
Cząsteczka Cldwa jest homojądrowy i niepolarny, więc jego interakcjami międzycząsteczkowymi rządzą londyńskie siły rozpraszające i jego masy cząsteczkowe. W fazie gazowej odległość Cldwa-Cldwa jest stosunkowo krótki w porównaniu z innymi gazami, co po dodaniu do masy czyni go gazem trzykrotnie gęstszym od powietrza.
Światło może pobudzać i promować przejścia elektroniczne w obrębie orbitali molekularnych Cldwa; w konsekwencji pojawia się jego charakterystyczny żółtozielony kolor. Kolor ten nasila się w stanie ciekłym, a następnie częściowo zanika, gdy zestala się.
Gdy temperatura spada (-34 ºC), cząsteczki Cldwa stracić energię kinetyczną i odległość Cldwa-Cldwa maleje; dlatego te łączą się i ostatecznie określają ciekły chlor. To samo dzieje się, gdy system jest jeszcze bardziej schładzany (-101 ºC), teraz za pomocą cząsteczek Cldwa tak blisko siebie, że definiują kryształ rombowy.
Fakt, że kryształy chloru istnieją, wskazuje, że ich siły dyspersyjne są wystarczająco ukierunkowane, aby stworzyć wzór strukturalny; to znaczy warstwy molekularne Cldwa. Separacja tych warstw jest taka, że ich struktura nie zmienia się nawet pod ciśnieniem 64 GPa, ani nie wykazują przewodnictwa elektrycznego..
Gdzie znaleźć i uzyskać
Sole chlorkowe

Chlor w stanie gazowym nie występuje nigdzie na powierzchni Ziemi, ponieważ jest bardzo reaktywny i ma tendencję do tworzenia chlorków. Chlorki te są dobrze rozprowadzane w całej skorupie ziemskiej, a ponadto po milionach lat zmywania przez deszcze wzbogacają morza i oceany..
Spośród wszystkich chlorków, NaCl mineralnego halitu (górna ilustracja) jest najbardziej powszechny i występuje w dużych ilościach; następnie minerały silvin, KCl i karnalit, MgCldwaKCl 6HdwaO. Kiedy masy wodne wyparowują w wyniku działania Słońca, pozostawiają po sobie pustynne słone jeziora, z których można bezpośrednio wydobywać NaCl jako surowiec do produkcji chloru..
Elektroliza solanki
NaCl rozpuszcza się w wodzie, tworząc solankę (26%), która jest poddawana elektrolizie w ogniwie chloro-alkalicznym. Tam w przedziale anodowym i katodowym zachodzą dwie półreakcje:
2Cl-(ac) => Cldwa(g) + 2e- (Anoda)
2HdwaO (l) + 2e- => 2OH-(ac) + Hdwa(g) (katoda)
Równanie globalne dla obu reakcji to:
2NaCl (aq) + 2HdwaO (l) => 2 NaOH (aq) + Hdwa(g) + Cldwa(sol)
W miarę postępu reakcji jony Na+ utworzone na anodzie migrują do przedziału katodowego przez przepuszczalną membranę azbestową. Z tego powodu NaOH znajduje się po prawej stronie równania globalnego. Oba gazy, Cldwa i Hdwa, są zbierane odpowiednio z anody i katody.
Poniższy obraz ilustruje to, co właśnie zostało napisane:
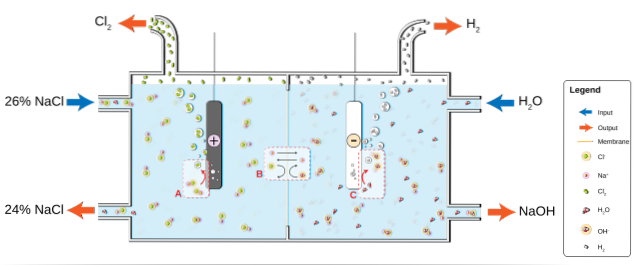
Zwróć uwagę, że stężenie solanki na końcu spada o 2% (wzrasta z 24 do 26%), co oznacza, że część jej anionów Cl- oryginały zostały przekształcone w cząsteczki Cldwa. Ostatecznie uprzemysłowienie tego procesu dało metodę produkcji chloru, wodoru i wodorotlenku sodu.
Kwasowe rozpuszczanie piroluzytu
Jak wspomniano w części dotyczącej historii, gazowy chlor można wytwarzać rozpuszczając próbki minerału piroluzytu kwasem solnym. Poniższe równanie chemiczne przedstawia produkty otrzymane w wyniku reakcji:
MnOdwa(s) + 4HCl (aq) => MnCldwa(aq) + 2HdwaO (l) + Cldwa(sol)
Stopy
Stopy chloru nie istnieją z dwóch prostych powodów: ich cząsteczki gazowe nie mogą zostać uwięzione między kryształami metali, a także są bardzo reaktywne, więc reagowałyby natychmiast z metalami, wytwarzając odpowiednie chlorki..
Z drugiej strony, chlorki również nie są pożądane, ponieważ po rozpuszczeniu w wodzie wywierają działanie soli, które sprzyja korozji stopów; i dlatego metale rozpuszczają się, tworząc chlorki metali. Proces korozji dla każdego stopu jest inny; niektóre są bardziej podatne niż inne.
Dlatego chlor w ogóle nie jest dobrym dodatkiem do stopów; ani jak Cldwa ani jak Cl- (a atomy Cl byłyby bardzo reaktywne, więc mogą nawet istnieć).
Ryzyka
Chociaż rozpuszczalność chloru w wodzie jest niska, wystarczy, że w wilgoci naszej skóry i oczu wytworzy się kwas solny, który w efekcie doprowadzi do korozji tkanek, powodując poważne podrażnienia, a nawet utratę wzroku..
Jeszcze gorzej oddycha zielonkawo-żółtymi oparami, ponieważ w płucach ponownie wytwarza kwasy i uszkadza tkankę płucną. Z tego powodu osoba doświadcza bólu gardła, kaszlu i trudności w oddychaniu z powodu płynów tworzących się w płucach.
W przypadku wycieku chloru znajdujesz się w szczególnie niebezpiecznej sytuacji: powietrze nie może po prostu „zmieść” jego oparów; pozostają tam, aż zareagują lub powoli się rozproszą.
Oprócz tego jest związkiem silnie utleniającym, dzięki czemu różne substancje mogą z nim reagować wybuchowo przy najmniejszym kontakcie; podobnie jak wełna stalowa i aluminium. Dlatego tam, gdzie jest przechowywany chlor, należy podjąć wszelkie niezbędne względy, aby uniknąć ryzyka pożaru..
Jak na ironię, chociaż gazowy chlor jest śmiertelny, jego anion chlorkowy nie jest toksyczny; Można go spożywać (z umiarem), nie pali się, nie reaguje z wyjątkiem fluoru i innych odczynników.
Aplikacje
Synteza
Około 81% produkowanego rocznie chloru gazowego jest wykorzystywane do syntezy organicznych i nieorganicznych chlorków. W zależności od stopnia kowalencyjności tych związków, chlor można znaleźć jako zwykłe atomy Cl w chlorowanych cząsteczkach organicznych (z wiązaniami C-Cl) lub jako jony Cl- w kilku solach chlorkowych (NaCl, CaCldwa, MgCldwa, itp.).
Każdy z tych związków ma swoje własne zastosowania. Na przykład chloroform (CHCl3) i chlorek etylu (CH3CHdwaCl) to rozpuszczalniki, które zaczęto stosować jako anestetyki wziewne; dichlorometan (CHdwaCldwa) i czterochlorek węgla (CCl4), tymczasem są rozpuszczalnikami szeroko stosowanymi w laboratoriach chemii organicznej.
Gdy te chlorowane związki są ciekłe, przez większość czasu są używane jako rozpuszczalniki organicznych mediów reakcyjnych..
W innych związkach obecność atomów chloru oznacza wzrost momentu dipolowego, więc mogą one oddziaływać w większym stopniu z macierzą polarną; jeden złożony z białek, aminokwasów, kwasów nukleinowych itp., biocząsteczek. Zatem chlor odgrywa również rolę w syntezie leków, pestycydów, insektycydów, fungicydów itp..
Jeśli chodzi o chlorki nieorganiczne, są one zwykle używane jako katalizatory, surowiec do otrzymywania metali metodą elektrolizy lub źródła jonów Cl.-.
Biologiczny
Chlor gazowy lub pierwiastkowy nie odgrywa żadnej roli w organizmach żywych poza niszczeniem ich tkanek. Nie oznacza to jednak, że jego atomów nie można znaleźć w organizmie. Na przykład jony Cl- są bardzo obfite w środowisku komórkowym i zewnątrzkomórkowym i pomagają kontrolować poziom jonów Na+ i Cadwa+, przeważnie.
Podobnie kwas solny jest częścią soku żołądkowego, z którym pokarm jest trawiony w żołądku; jego jony Cl-, w towarzystwie H.3LUB+, określić pH bliskie 1 z tych wydzielin.
Broń chemiczna
Gęstość chloru gazowego sprawia, że jest on śmiertelną substancją w przypadku rozlania lub wlania do zamkniętych lub otwartych przestrzeni. Ponieważ jest gęstszy od powietrza, jego prąd nie przenosi łatwo chloru, więc pozostaje przez dłuższy czas, zanim ostatecznie się rozproszy.
Na przykład podczas I wojny światowej chlor ten był używany na polach bitew. Po uwolnieniu zakradał się do okopów, aby udusić żołnierzy i zmusić ich do wynurzenia..
Środek dezynfekujący

Roztwory chlorowane, czyli takie, w których gazowy chlor został rozpuszczony w wodzie, a następnie zalkalizowany buforem, mają doskonałe właściwości dezynfekujące, a także hamują gnicie tkanek. Były używane do dezynfekcji otwartych ran w celu wyeliminowania chorobotwórczych bakterii.
Woda w basenie jest precyzyjnie chlorowana, aby wyeliminować bakterie, drobnoustroje i pasożyty, które mogą się w niej gromadzić. Kiedyś stosowano do tego celu chlor gazowy, jednak jego działanie jest dość agresywne. Zamiast tego stosuje się roztwory podchlorynu sodu (wybielacz) lub tabletki kwasu trichloroizocyjanurowego (TCA)..
Z powyższego wynika, że nie jest to Cldwa ten, który ma działanie dezynfekujące, ale HClO, kwas podchlorynowy, który wytwarza rodniki O niszczące mikroorganizmy.
Wybielacz
Chlor, podobnie jak jego działanie dezynfekujące, wybiela również materiały, ponieważ barwniki odpowiedzialne za kolory są degradowane przez HClO. Dlatego chlorowane roztwory są idealne do usuwania plam z białej odzieży lub do wybielania masy papierniczej..
Chlorek winylu
Najważniejszym związkiem chloru ze wszystkich, który stanowi około 19% pozostałej produkcji chloru gazowego, jest polichlorek winylu (PCW). Ten plastik ma wiele zastosowań. Dzięki niemu wykonuje się rury wodociągowe, ramy okienne, okładziny ścienne i podłogowe, przewody elektryczne, worki na kroplówki, płaszcze itp..
Bibliografia
- Shiver & Atkins. (2008). Chemia nieorganiczna. (Czwarta edycja). Mc Graw Hill.
- Wikipedia. (2019). Chlor. Odzyskane z: en.wikipedia.org
- Laura H. i in. (2018). Struktura stałego chloru przy 1,45 GPaZeitschrift für Kristallographie. Materiały krystaliczne, tom 234, wydanie 4, strony 277-280, ISSN (online) 2196-7105, ISSN (druk) 2194-4946, DOI: doi.org/10.1515/zkri-2018-2145
- Narodowe Centrum Informacji Biotechnologicznej. (2019). Chlor. Baza danych PubChem. CID = 24526. Odzyskany z: pubchem.ncbi.nlm.nih.gov
- Marques Miguel. (s.f.). Chlor. Odzyskany z: nautilus.fis.uc.pt
- Amerykańska Rada Chemii. (2019). Chemia chloru: Wprowadzenie do chloru. Odzyskany z: chlorine.americanchemistry.com
- Fong-Yuan Ma. (S.f.). Żrący wpływ chlorków na metale. Department of Marine Engineering, NTOU Republic of China (Tajwan).
- Stan Nowy Jork. (2019). Fakty dotyczące chloru. Odzyskany z: health.ny.gov
- Dr Doug Stewart. (2019). Fakty dotyczące pierwiastka chloru. Chemicool. Źródło: chemicool.com



Jeszcze bez komentarzy