
Właściwości, zagrożenia i zastosowania chlorku litu (LiCl)
Plik Chlorek litu Jest to związek chemiczny o wzorze LiCl, który można wytworzyć przez zapalenie litu i chloru, chociaż jest to trudne, ponieważ reakcja jest gwałtowna. W ten sposób powstaje postać bezwodna (bez wody). Chlorek litu można także wyekstrahować alkoholem amylowym z innych chlorków metali alkalicznych..
Do lat 90. na rynku metali i litu dominowała amerykańska produkcja ze złóż mineralnych. Jednak na początku XXI wieku większość produkcji pochodziła ze źródeł spoza USA, a najważniejszymi dostawcami na świecie były Australia, Chile i Portugalia..
Jako ciekawostkę warto dodać, że choć Boliwia posiada połowę światowych złóż litu, to nie jest dużym producentem..
Najważniejszą formą handlową jest węglan litu, LidwaWSPÓŁ3, produkowane z minerałów lub solanek w kilku różnych procesach.
Dodatek kwasu solnego (HCl) daje chlorek litu. Dzięki tej metodzie powstaje uwodniony związek (woda związana z cząsteczką). Postać uwodnioną można wysuszyć do postaci bezwodnej przez ogrzewanie jej gazowym chlorowodorem..
Właściwości fizyczne i chemiczne chlorku litu
Chlorek litu to biała substancja stała bez szczególnego aromatu i słonego smaku (National Center for Biotechnology Information, 2005). Jego wygląd pokazano na rysunku 2.

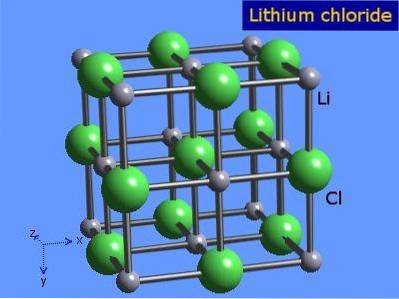
Chlorek litu to wysoce higroskopijne kryształy o oktaedrycznej geometrii podobnej do chlorku sodu. Jego strukturę krystaliczną przedstawiono na rysunku 3 (Winter, S.F.).
Jego masa cząsteczkowa wynosi 42,39 g / mol, gęstość 2,068 g / ml, a jego temperatura topnienia i wrzenia wynosi odpowiednio 605 ° C i 1360 ° C..
Związek jest bardzo dobrze rozpuszczalny w wodzie, alkoholu, eterze, pirydynie i nitrobenzenie (Royal Society of Chemistry, 2015).
Chlorek litu ma słabą siłę utleniającą lub redukującą. Jednak nadal mogą zachodzić reakcje redoks. Roztwory chlorku litu zazwyczaj nie są ani silnie kwaśne, ani silnie zasadowe..
Ponieważ jest wyjątkowo higroskopijny, chlorek litu może również absorbować do czterech równoważników amoniaku na mol. Wodne roztwory chlorku litu mogą powodować korozję metali (LITHIUM CHLORIDE, S.F.).
Reaktywność i zagrożenia
Chlorek litu jest trwałym związkiem niekompatybilnym z silnymi utleniaczami, mocnymi kwasami, trichlorek bromu, trifluorek bromu.
Nie jest toksyczny po połknięciu, ale ze względu na swój żrący charakter może działać drażniąco w kontakcie ze skórą i oczami, może również podrażniać przewody nosowe (National Institute for Occupational Safety and Health, 2015).
W przypadku kontaktu z oczami sprawdź, czy nosisz soczewki kontaktowe i natychmiast je zdejmij..
Oczy należy przepłukiwać bieżącą wodą przez co najmniej 15 minut, trzymając powieki otwarte. Można użyć zimnej wody. Nie należy stosować maści do oczu.
Jeśli substancja chemiczna wejdzie w kontakt z ubraniem, zdejmij ją tak szybko, jak to możliwe, chroniąc własne ręce i ciało.
Umieść ofiarę pod prysznicem bezpieczeństwa. Jeśli substancja chemiczna gromadzi się na odsłoniętej skórze ofiary, takiej jak ręce, zanieczyszczoną skórę należy delikatnie i ostrożnie umyć pod bieżącą wodą i nieściernym mydłem..
Można użyć zimnej wody. Jeśli podrażnienie utrzymuje się, zasięgnąć porady lekarza. Wyprać zanieczyszczoną odzież przed ponownym użyciem.
W przypadku wdychania poszkodowanego należy pozwolić odpocząć w dobrze wentylowanym miejscu. Jeśli wdychanie jest ciężkie, ofiarę należy jak najszybciej ewakuować w bezpieczne miejsce..
Poluzuj ciasną odzież, taką jak kołnierzyk koszuli, pasek lub krawat. Jeśli ofiara ma trudności z oddychaniem, należy podać tlen.
Jeśli ofiara nie oddycha, przeprowadza się resuscytację usta-usta. Zawsze należy pamiętać, że wykonanie resuscytacji usta-usta może być niebezpieczne dla osoby udzielającej pomocy, gdy wdychany materiał jest toksyczny, zakaźny lub żrący..
We wszystkich przypadkach należy natychmiast zwrócić się o pomoc lekarską (Karta charakterystyki materiału Chlorek litu, 2013).
Aplikacje
Chlorek litu jest związkiem używanym do produkcji metalicznego litu metodą elektrolizy. Lit metaliczny jest wytwarzany przez elektrolizę stopionej mieszaniny chlorków litu i potasu.
Niższa temperatura topnienia mieszaniny (400-420 ° C lub 750-790 ° F) w porównaniu z czystym chlorkiem litu (610 ° C lub 1130 ° F) umożliwia pracę w niższej temperaturze elektrolizy.
Ponieważ napięcie, przy którym następuje rozkład chlorku litu, jest niższe niż w przypadku chlorku potasu, lit osadza się na poziomie czystości większym niż 97 procent (Dye, 2017).
Ciekły chlorek litu służy jako środek osuszający, który może obniżyć poziom wilgotności w otaczającym powietrzu nawet o 15 procent.
Płynne środki osuszające, które łączą chlorek litu i chlorek wapnia, tworzą substancję tańszą niż chlorek litu, ale bardziej stabilną niż chlorek wapnia..
Chlorek litu szybko chłodzi powietrze, ponieważ substancja chemiczna zawiera ogromną ilość wody jak na swoją masę ciała stałego. Substancja osusza również duże ilości gazów przemysłowych.
Chlorek litu to czerwony barwnik stosowany w pokazach pirotechnicznych, takich jak fajerwerki. Chlorek litu lub jakakolwiek rozpuszczalna w wodzie sól na bazie litu pali się na czerwono po włączeniu.
Specjalne efekty pirotechniczne można zapalić mieszając sole jonowe z łatwopalnymi cieczami, takimi jak alkohol metylowy..
W latach czterdziestych XX wieku chlorek litu służył jako substytut soli kuchennej, ale niektórzy pacjenci zmarli z powodu toksycznego poziomu litu..
Związek ma zastosowania farmakologiczne jako antymaniaki, czyli środki stosowane w leczeniu zaburzeń afektywnych dwubiegunowych lub manii związanej z innymi zaburzeniami afektywnymi..
Ciało ludzkie zwykle zawiera około 7 miligramów litu w danym momencie..
Lit występuje naturalnie w roślinach, ponieważ organizmy wykorzystują tę substancję do stymulowania wzrostu.
Bibliografia
- Dye, J. L. (23 stycznia 2017). Lit (Li). Odzyskany z britannica: britannica.com.
- EMBL-EBI. (23 listopada 2009). chlorek litu. Odzyskany z ChEBI: ebi.ac.uk.
- CHLOREK LITU. (S.F.). Odzyskany z CAMEO: cameochemicals.noaa.gov.
- Karta charakterystyki materiału Chlorek litu. (2013, 21 maja). Odzyskany z sciencelab.com.
- National Center for Biotechnology Information… (2005, 26 marca). Baza danych PubChem Compound; CID = 433294. Odzyskane z PubChem.
- Narodowy Instytut Bezpieczeństwa i Higieny Pracy. (22 lipca 2015). CHLOREK LITU. Odzyskany z cdc.gov.
- Zima, M. (S.F.). Lit: chlorek litu. Odzyskane z elementów sieciowych.



Jeszcze bez komentarzy