
Charakterystyka związków czwartorzędowych, powstawanie, przykłady
Plik związki czwartorzędowe Są to wszystkie te, które mają cztery różne atomy lub jony. Dlatego mogą być gatunkami molekularnymi lub jonowymi. Ich różnorodność obejmuje zarówno chemię organiczną, jak i nieorganiczną, stanowiącą bardzo obszerną grupę; chociaż może nie tak bardzo w porównaniu ze związkami binarnymi lub trójskładnikowymi.
Powodem, dla którego ich liczba jest mniejsza, jest to, że cztery atomy lub jony muszą być utrzymywane razem przez ich chemiczne powinowactwo. Nie wszystkie elementy są ze sobą kompatybilne, a tym bardziej w przypadku kwartetu; nagle para z nich jest do siebie bardziej podobna niż do drugiej pary.
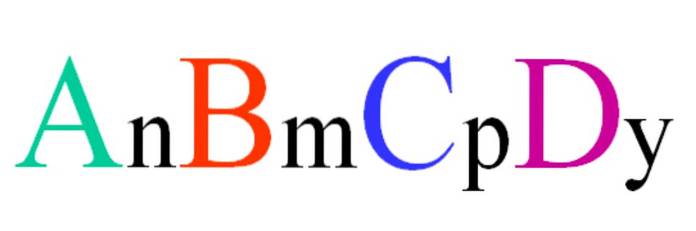
Rozważmy czwartorzędowy związek o losowym wzorze ABCD. Indeksy dolne n, m, p i y to współczynniki stechiometryczne, które z kolei wskazują, jaka jest proporcja każdego atomu w stosunku do pozostałych..
Zatem formuła AnbmdopreY będzie ważny, jeśli będzie zgodny z elektroobojętnością. Co więcej, taki związek będzie możliwy, jeśli jego cztery atomy są ze sobą dostatecznie spokrewnione. Okaże się, że ten wzór nie dotyczy wielu związków, ale szczególnie stopów lub minerałów..
Indeks artykułów
- 1 Charakterystyka związków czwartorzędowych
- 1.1 Chemia
- 1.2 Fizyczne
- 2 Nazewnictwo
- 2.1 Kwaśne utleniacze
- 2.2 Podstawowe oxisales
- 2.3 Sole podwójne
- 2.4 Sole uwodnione
- 3 Szkolenie
- 4 Przykłady
- 5 Referencje
Charakterystyka związków czwartorzędowych
Chemiczny
Czwartorzędowy związek może być jonowy lub kowalencyjny, wykazując cechy oczekiwane ze względu na jego naturę. Oczekuje się, że jonowe związki ABCD będą rozpuszczalne w wodzie, alkoholach lub innych polarnych rozpuszczalnikach; powinny mieć wysoką temperaturę wrzenia i topnienia, a po stopieniu być dobrymi przewodnikami elektryczności.
Jeśli chodzi o kowalencyjne związki ABCD, większość składa się z azotowych, utlenionych lub chlorowcowanych związków organicznych; to znaczy, że jego formuła stałaby się CnH.mLUBpNY lub CnH.mLUBpXY, gdzie X oznacza atom halogenu. Spośród tych cząsteczek logiczne byłoby myślenie, że są one polarne, biorąc pod uwagę wysokie elektroujemności O, N i X.
Czysto kowalencyjny związek ABCD może mieć wiele możliwości wiązania: A-B, B-C, D-A itp., Oczywiście w zależności od powinowactwa i pojemności elektronowej atomów. Podczas gdy w czysto jonowym związku ABCD jego oddziaływania są elektrostatyczne: A.+b-do+re-, na przykład.
W przypadku stopu, uważanego właściwie bardziej za mieszaninę stałą niż związek, ABCD składa się z neutralnych atomów w stanach podstawowych (w teorii).
Z pozostałych, związek ABCD może być obojętny, kwaśny lub zasadowy, w zależności od tożsamości jego atomów..
Fizyczny
Fizycznie rzecz biorąc, jest prawdopodobne, że ABCD nie stanie się gazem, ponieważ cztery różne atomy zawsze implikują wyższą masę cząsteczkową lub wyższą formułę. Jeśli nie jest to ciecz o wysokiej temperaturze wrzenia to należy się spodziewać, że jest to ciało stałe, którego rozkład musi generować wiele produktów.
Ponownie, ich kolory, zapach, tekstura, kryształy itp. Będą zależały od tego, jak A, B, C i D współistnieją w związku, i będą zależeć od ich synergii i struktury..
Nomenklatura
Jak dotąd do kwestii związków czwartorzędowych podchodzono w sposób globalny i nieprecyzyjny. Pomijając chemię organiczną (amidy, chlorki benzylu, czwartorzędowe sole amoniowe itp.), W chemii nieorganicznej istnieją dobrze zdefiniowane przykłady zwane kwaśnymi i zasadowymi solami oksysolowymi..
Acid oxisales
Kwaśne oksysole to takie, które pochodzą z częściowej neutralizacji poliprotycznego kwasu okso. Tak więc jeden lub więcej jego wodorów jest zastąpionych przez kationy metali, a im mniej pozostających wodorów, tym mniej będzie kwaśny..
Na przykład z kwasu fosforowego H3PO4, Można otrzymać do dwóch kwaśnych soli, na przykład sodu. Są to: NaHdwaPO4 (Na+ zastępuje wodór równoważny H+) i NadwaHPO4.
Zgodnie z tradycyjną nomenklaturą, sole te są nazywane w ten sam sposób, co oksysole (całkowicie deprotonowane), ale ze słowem „kwas” poprzedzającym nazwę metalu. Zatem NaHdwaPO4 byłby fosforanem dikwasu sodu i NadwaHPO4 kwaśny fosforan sodu (ponieważ ma jeden H).
Z drugiej strony nomenklatura zapasów woli używać słowa „wodór” niż „kwas”. NaHdwaPO4 stałby się wówczas diwodorofosforanem sodu i NadwaHPO4 wodorofosforan sodu. Zauważ, że te sole mają cztery atomy: Na, H, P i O.
Podstawowe oxisales
Podstawowe oksysole to takie, które zawierają w swoim składzie anion OH-. Weźmy na przykład sól CaNO3OH (Cadwa+ NIE3- O-). Aby go nazwać, wystarczy poprzedzić słowo „podstawowe” przed nazwą metalu. Tak więc jego nazwa brzmiałaby: zasadowy azotan wapnia. A co powiesz na CuIO3O? Jego nazwa brzmiałaby: zasadowy jodan miedzi (Cudwa+ IO3- O-).
Zgodnie z nomenklaturą zapasów słowo „podstawowe” zastępuje się wodorotlenkiem, po którym następuje łącznik przed nazwą oksoanionu.
Powtarzając poprzednie przykłady, ich nazwy brzmiałyby dla każdego z nich: wodorotlenek wapnia i jodan wodorotlenku miedzi (II); pamiętając, że wartościowość metalu należy podać w nawiasach i cyframi rzymskimi.
Sole podwójne
W solach podwójnych występują dwa różne kationy oddziałujące z tym samym typem anionu. Załóżmy, że sól podwójna: Cu3Wiara (PO4)3 (Cudwa+ Wiara3+ PO43-). Jest to fosforan żelaza i miedzi, ale najodpowiedniejszą nazwą, aby się do niego odwołać, jest: potrójny fosforan miedzi (II) i żelaza (III).
Sole uwodnione
Są to hydraty, a jedyną różnicą jest to, że na końcu ich nazw podana jest liczba potrzebnych do przygotowania wody. Na przykład MnCldwa to chlorek manganu (II).
Jego hydrat, MnCldwa4HdwaLub nazywany jest czterowodzianem chlorku manganu (II). Zauważ, że istnieją cztery różne atomy: Mn, Cl, H i O.
Słynna podwójnie uwodniona sól to Mohra, Fe (NH4)dwa(POŁUDNIOWY ZACHÓD4)dwa6HdwaO. Nazywa się: podwójny siarczan żelaza (II) i heksahydrat amonu.
Trening
Ponownie, skupiając się na nieorganicznych związkach czwartorzędowych, wydaje się, że są one głównie produktem częściowej neutralizacji. Jeśli występują one w obecności kilku tlenków metali, prawdopodobne jest powstanie soli podwójnych; a jeśli pożywka jest bardzo zasadowa, wytrącają się zasadowe oksysole.
A jeśli, z drugiej strony, cząsteczki wody mają powinowactwo do metalu, będą koordynować się bezpośrednio z nim lub z otaczającymi go jonami, tworząc hydraty.
Po stronie stopu należy spawać cztery różne metale lub metaloidy, aby uzyskać kondensatory, półprzewodniki lub tranzystory..
Przykłady
Wreszcie lista z różnymi przykładami związków czwartorzędowych jest pokazana poniżej. Czytelnik może go użyć do sprawdzenia swojej znajomości nazewnictwa:
- PbCO3(O)dwa
- Cr (HSO4)3
- NaHCO3
- ZnIOH
- Cudwa(O)dwapołudniowy zachód3
- LidwaKAsO4
- KIERUNEK45HdwaLUB
- AgAu (SO4)dwa
- Walizka42HdwaLUB
- FeCl36HdwaLUB
Bibliografia
- Shiver & Atkins. (2008). Chemia nieorganiczna. (Czwarta edycja). Mc Graw Hill.
- Whitten, Davis, Peck & Stanley. (2008). Chemia. (8th ed.). CENGAGE Learning.
- Nazewnictwo i sformułowanie nieorganiczne. [PDF]. Odzyskane z: recursostic.educacion.es
- Erika Thalîa Good. (2019). Sole podwójne. Akademia. Odzyskany z: academia.edu
- Wikipedia. (2019). Czwartorzędowy kation amoniowy. Odzyskane z: en.wikipedia.org



Jeszcze bez komentarzy