
Struktura, klasyfikacja, funkcja i znaczenie palców cynkowych
Plik palce cynkowe (ZF) to motywy strukturalne obecne w wielu białkach eukariotycznych. Należą do grupy metaloprotein, ponieważ są zdolne do wiązania jonu metalu cynku, którego potrzebują do swojego działania. Przewiduje się, że w około 1000 różnych białkach u ludzi istnieje ponad 1500 domen ZF..
Termin palec cynkowy lub „palec cynkowy” został po raz pierwszy ukuty w 1985 roku przez Millera, McLachlana i Kluga, podczas szczegółowych badań małych domen wiążących DNA czynnika transkrypcyjnego TFIIIA Xenopus laevis, opisane przez innych autorów kilka lat wcześniej.
Białka z motywami ZF należą do najliczniej występujących w genomie organizmów eukariotycznych i biorą udział w wielu podstawowych procesach komórkowych, w tym transkrypcji genów, translacji białek, metabolizmie, fałdowaniu i składaniu innych białek i lipidów., Programowanej śmierci komórki, między innymi inne.
Indeks artykułów
- 1 Struktura
- 2 Klasyfikacja
- 2,1 C2H2
- 2,2 C2H
- 2,3 C4 (łuk lub wstążka)
- 2,4 C4 (rodzina GATA)
- 2,5 C6
- 2.6 Palce cynkowe (C3HC4-C3H2C3)
- 2,7 H2C2
- 3 Funkcje
- 4 Znaczenie biotechnologiczne
- 5 Referencje
Struktura
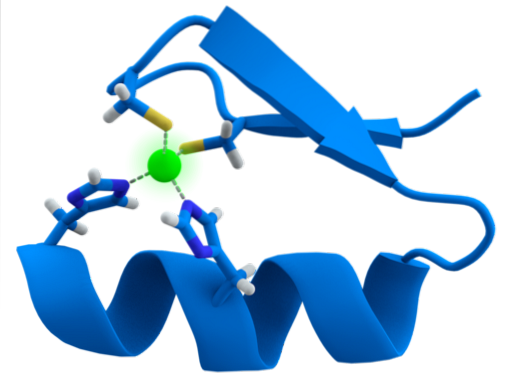
Struktura motywów ZF jest wyjątkowo zachowana. Zwykle te powtarzające się regiony mają od 30 do 60 aminokwasów, których struktura drugorzędowa występuje jako dwa antyrównoległe arkusze beta, które tworzą spinkę do włosów i alfa helisę, co jest oznaczone jako ββα.
Wspomniana struktura drugorzędowa jest stabilizowana przez oddziaływania hydrofobowe i przez koordynację atomu cynku przez dwie reszty cysteiny i dwie reszty histydyny (CysdwaJegodwa). Istnieją jednak ZF, które mogą koordynować więcej niż jeden atom cynku i inne, w których kolejność reszt Cys i His jest różna..
ZF można znaleźć powtórzone w partiach, skonfigurowane liniowo w tym samym białku. Wszystkie mają podobną strukturę, ale można je chemicznie odróżnić od siebie na podstawie zmian reszt aminokwasowych kluczowych dla spełnienia ich funkcji.
Wspólną cechą ZF jest ich zdolność do rozpoznawania cząsteczek DNA lub RNA o różnej długości, dlatego początkowo uważano je tylko za czynniki transkrypcyjne.
Ogólnie rzecz biorąc, rozpoznawanie dotyczy regionów 3 pz w DNA i jest osiągane, gdy białko z domeną ZF przedstawia helisę alfa w głównym rowku cząsteczki DNA.
Klasyfikacja
Istnieją różne motywy ZF, które różnią się od siebie charakterem i różnymi konfiguracjami przestrzennymi uzyskanymi dzięki wiązaniom koordynacyjnym z atomem cynku. Jedna z klasyfikacji jest następująca:
dodwaH.dwa
To często spotykany motyw w ZF-ach. Większość motywów C.dwaH.dwa Są specyficzne dla interakcji z DNA i RNA, jednak zaobserwowano, że uczestniczą w interakcjach białko-białko. Mają od 25 do 30 reszt aminokwasowych i znajdują się w największej rodzinie białek regulatorowych w komórkach ssaków.
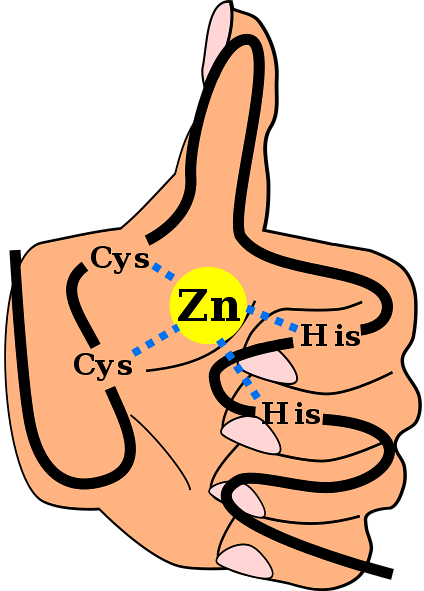
dodwaH.
Oddziałują z RNA i niektórymi innymi białkami. Obserwuje się je głównie jako część niektórych białek kapsydu retrowirusa, pomagając w pakowaniu wirusowego RNA tuż po replikacji..
do4 (łuk lub wstążka)
Białka z tym motywem to enzymy odpowiedzialne za replikację i transkrypcję DNA. Dobrym tego przykładem mogą być grube enzymy fagów T4 i T7.
do4 (Rodzina GATA)
Ta rodzina ZF obejmuje czynniki transkrypcyjne, które regulują ekspresję ważnych genów w wielu tkankach podczas rozwoju komórki. Na przykład czynniki GATA-2 i 3 są zaangażowane w hematopoezę.
do6
Domeny te są typowe dla drożdży, a konkretnie białka GAL4, które aktywuje transkrypcję genów zaangażowanych w stosowanie galaktozy i melibiozy..
Palce cynkowe (C3HC4-do3H.dwado3)
Te konkretne struktury mają 2 podtypy domen ZF (C3HC4 i C3H.dwado3) i są obecne w wielu białkach zwierzęcych i roślinnych.
Występują w białkach takich jak RAD5, zaangażowanych w naprawę DNA organizmów eukariotycznych. Występują również w RAG1, niezbędnym do rekonfiguracji immunoglobulin.
H.dwadodwa
Ta domena ZF jest silnie konserwowana w integrazach retrowirusów i retrotranspozonów; wiążąc się z docelowym białkiem, powoduje w nim zmianę konformacyjną.
funkcje
Białka z domenami ZF służą różnym celom: można je znaleźć w białkach rybosomalnych lub w adapterach transkrypcyjnych. Zostały również wykryte jako integralna część struktury drożdżowej polimerazy RNA II..
Wydaje się, że biorą udział w wewnątrzkomórkowej homeostazie cynku oraz w regulacji apoptozy lub programowanej śmierci komórki. Ponadto istnieją białka z ZF, które działają jako chaperony przy fałdowaniu lub transporcie innych białek..
Wiązanie z lipidami i podstawowa rola w interakcjach białko-białko są również głównymi funkcjami domen ZF w niektórych białkach..
Znaczenie biotechnologiczne
Z biegiem lat strukturalne i funkcjonalne zrozumienie domen ZF umożliwiło wielki postęp naukowy, który obejmuje wykorzystanie ich cech do celów biotechnologicznych..
Ponieważ niektóre białka z ZF mają wysoką specyficzność wobec pewnych domen DNA, obecnie wiele wysiłku wkłada się w projektowanie określonych ZF, które mogą zapewnić cenne postępy w terapii genowej u ludzi.
Ciekawe zastosowania biotechnologiczne wynikają również z projektowania białek z genetycznie zmodyfikowanymi ZF. W zależności od pożądanego celu, niektóre z nich można modyfikować przez dodanie peptydów palcowych „polycynkowych”, które są zdolne do rozpoznawania praktycznie dowolnej sekwencji DNA z wysokim powinowactwem i specyficznością..
Edycja genomu zmodyfikowana nukleazą jest obecnie jedną z najbardziej obiecujących aplikacji. Ten rodzaj edycji daje możliwość przeprowadzenia badań funkcji genetycznej bezpośrednio w modelowym systemie zainteresowania..
Inżynieria genetyczna z wykorzystaniem zmodyfikowanych nukleaz ZF przyciągnęła uwagę naukowców zajmujących się genetycznym ulepszaniem odmian roślin o znaczeniu rolniczym. Te nukleazy zostały użyte do skorygowania endogennego genu, który wytwarza formy odporne na herbicydy w roślinach tytoniu..
Nukleazy z ZF stosowano również do dodawania genów w komórkach ssaków. Omawiane białka wykorzystano do wygenerowania zestawu izogenicznych mysich komórek z serią alleli zdefiniowanych dla endogennego genu..
Taki proces ma bezpośrednie zastosowanie w znakowaniu i tworzeniu nowych form allelicznych do badania związków struktury i funkcji w natywnych warunkach ekspresji oraz w środowiskach izogenicznych..
Bibliografia
- Berg, J. M. (1990). Domeny palców cynkowych: hipotezy i aktualna wiedza. Annual Review of Biophysics and Biophysical Chemistry, 19(39), 405-421.
- Dreier, B., Beerli, R., Segal, D., Flippin, J., & Barbas, C. (2001). Opracowanie domen palca cynkowego do rozpoznawania sekwencji DNA rodziny 5'-ANN-3 'i ich zastosowanie w konstrukcji sztucznych czynników transkrypcyjnych. JBC, (54).
- Gamsjaeger, R., Liew, C. K., Loughlin, F. E., Crossley, M. i Mackay, J. P. (2007). Lepkie palce: palce cynkowe jako motywy rozpoznawania białek. Trendy w naukach biochemicznych, 32(2), 63-70.
- Klug, A. (2010). Odkrycie palców cynkowych i ich zastosowania w regulacji genów i manipulacji genomami. Roczny przegląd biochemii, 79(1), 213-231.
- Kluska, K., Adamczyk, J. i Krȩzel, A. (2017). Właściwości wiązania metalu w palcach cynkowych z naturalnie zmienionym miejscem wiązania metalu. Metalomika, 10(2), 248-263.
- Laity, J. H., Lee, B. M. i Wright, P. E. (2001). Białka palców cynkowych: nowe spojrzenie na różnorodność strukturalną i funkcjonalną. Aktualna opinia w biologii strukturalnej, jedenaście(1), 39-46.
- Miller, J., McLachlan, A. D. i Klug, A. (1985). Powtarzające się domeny wiążące cynk w białkowym czynniku transkrypcji IIIA z oocytów Xenopus. Journal of Trace Elements in Experimental Medicine, 4(6), 1609-1614.
- Urnov, F. D., Rebar, E. J., Holmes, M. C., Zhang, H. S. i Gregory, P. D. (2010). Edycja genomu za pomocą zaprojektowanych nukleaz palca cynkowego. Nature Reviews Genetics, jedenaście(9), 636-646.



Jeszcze bez komentarzy