
Właściwości, produkcja, zastosowania dichromianu sodu (Na2Cr2O7)

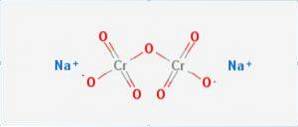
Plik dichromian sodu jest to związek nieorganiczny o wzorze Na2Cr2O7. Jest jednym z wielu związków chromu sześciowartościowego (Cr VI). Jego strukturę przedstawiono na rysunku 1, chociaż sól jest zwykle przetwarzana w postaci dihydratowanej, której wzór byłby następujący: Na2Cr2O7 · H2O.
Ma dwa wiązania jonowe między cząsteczkami sodu i ujemnie naładowanym tlenem. Ruda chromu jest ekstrahowana z dwuchromianu sodu. Rocznie produkuje się miliony kilogramów dichromianu sodu.
Chiny są największym producentem dwuchromianu sodu, jednak chińskie zakłady chemiczne mają stosunkowo niską produkcję, poniżej 50 000 ton rocznie, w porównaniu z zakładem w Kazachstanie, który produkuje ponad 100 000 ton rocznie..
Rośliny w Rosji, Stanach Zjednoczonych i Wielkiej Brytanii mają produkcję pośrednią między 50 000 a 100 000 ton rocznie (Kogel, 2006).
Pod względem reaktywności i wyglądu dichromian sodu ma podobne właściwości do dwuchromianu potasu, jednak sól sodowa jest lepiej rozpuszczalna w wodzie i ma mniejszą masę równoważnikową niż sól potasowa..
Dwuchromian sodu po podgrzaniu wydziela toksyczne opary chromu. Jest silnym utleniaczem i silnie korozyjnym.
Związek ten można znaleźć w zanieczyszczonych źródłach wody pitnej z różnych procesów przemysłowych, takich jak cynkowanie lub galwanizacja, garbowanie skóry i produkcja tekstyliów..
Indeks artykułów
- 1 Właściwości fizyczne i chemiczne
- 2 Metody produkcji
- 3 Reaktywność i zagrożenia
- 4 Zastosowania i aplikacje
- 5 Biochemistry
- 6 Odnośniki
Fizyczne i chemiczne właściwości
Dwuchromian sodu składa się z kryształów o strukturze jednoskośnej, które w postaci bezwodnej i bezwonnej mają czerwonawo-pomarańczowy kolor. Jego masa cząsteczkowa wynosi 261,97 g / mol w postaci bezwodnej i 298,00 g / mol w postaci dwuwodnej..
Ma temperaturę topnienia 356,7 stopni Celsjusza, temperaturę wrzenia 400 stopni Celsjusza, w której ulega rozkładowi. Ma gęstość 2,52 g / ml.

Wygląd dichromianu sodu przedstawiono na rycinie 2. Jego rozpuszczalność w wodzie wynosi 187 g na 100 gramów w temperaturze 25 stopni Celsjusza, a rozpuszczalność w etanolu wynosi 513,2 gramów na litr w temperaturze 19,4 stopni Celsjusza (National Center for Biotechnology Information, b.d.).
Jest uważany za stabilny związek, jeśli jest przechowywany w zalecanych warunkach i nie jest łatwopalny. Ponieważ jest silnym utleniaczem, jest korozyjny, aw roztworze jest kwasem mającym zdolność obniżania pH do 4 w 1% w / v roztworze..
Metody produkcji
Chromian sodu można przekształcić w dwuchromian w procesie ciągłym z kwasem siarkowym, dwutlenkiem węgla lub ich kombinacją..
Odparowanie ługu dichromianu sodu powoduje wytrącenie siarczanu sodu i / lub wodorowęglanu sodu, a związki te są usuwane przed ostateczną krystalizacją dichromianu sodu..
Dwuchromian sodu można wytworzyć w trzystopniowym procesie:
- Warunki utleniania prażonego chromitu alkalicznego
- Wymywanie. Ekstrakcja substancji rozpuszczalnych z mieszaniny za pomocą ciekłego rozpuszczalnika
- Konwersja monochromianu sodu do dwuchromianu sodu za pomocą kwasu.
Bezwodny dichromian sodu można wytworzyć przez stopienie dwuwodzianu dichromianu sodu, krystalizację wodnych roztworów dichromianu w temperaturze powyżej 86 stopni C lub suszenie roztworów dichromianu sodu w suszarkach rozpyłowych..
Roztwory dwuchromianu sodu o stężeniu 69 i 70% w / v są stosowane jako wygodna i opłacalna metoda wysyłki ilości, dzięki czemu nie ma potrzeby ręcznego przenoszenia lub rozpuszczania kryształów..
Reaktywność i zagrożenia
Jest silnym utleniaczem. Niekompatybilny z mocnymi kwasami. Kontakt z materiałami palnymi może spowodować pożar. Toksyczne opary tlenku chromu mogą powstawać w obecności ciepła lub ognia.
Dobrze znana „mieszanina kwasu chromowego” dichromianu i kwasu siarkowego z pozostałościami organicznymi powoduje gwałtowną reakcję egzotermiczną. Ta mieszanina w połączeniu z pozostałościami acetonu również prowadzi do gwałtownej reakcji..
Połączenie dichromianu i kwasu siarkowego z alkoholami, etanolem i 2-propanolem powoduje gwałtowną reakcję egzotermiczną. Ze względu na występowanie wielu incydentów związanych z mieszaniem kwasu dwuchromianowo-siarkowego z utleniającymi się materiałami organicznymi, prawdopodobnie najlepiej jest unikać takich interakcji..
Połączenie dichromianu z hydrazyną jest wybuchowe, można oczekiwać, że reakcja dichromianu będzie ogólnie energiczna z aminami. Dodanie odwodnionej soli dwuchromianowej do bezwodnika octowego prowadzi ostatecznie do wybuchowej reakcji egzotermicznej..
Bor, krzem i dichromiany tworzą mieszaniny pirotechniczne. Mieszanina kwasu octowego, 2-metylo-2-pentenalu i dichromianu prowadzi do gwałtownej reakcji (Chemical Datasheet Sodium Dichromate., 2016).
Wdychanie pyłu lub mgły powoduje podrażnienie dróg oddechowych, które czasami przypomina astmę. Może wystąpić perforacja przegrody. Uważa się, że jest trucizną.
Spożycie powoduje wymioty, biegunkę i, bardzo rzadko, powikłania żołądkowe i nerkowe. Kontakt z oczami lub skórą powoduje miejscowe podrażnienie. Powtarzające się narażenie skóry powoduje zapalenie skóry.
Dwuchromian sodu jest rakotwórczy dla ludzi. Istnieją dowody na to, że sześciowartościowy chrom lub związki Cr (VI) mogą powodować raka płuc u ludzi. Wykazano, że dwuchromian sodu powoduje raka płuc u zwierząt.
Chociaż nie zidentyfikowano dwuchromianu sodu jako związku teratogennego lub powodującego ryzyko reprodukcji, wiadomo, że sześciowartościowy chrom lub związki Cr (VI) są teratogenami i powodują uszkodzenia reprodukcyjne, takie jak zmniejszenie płodności i zaburzenie cykli miesiączkowych..
Dwuchromian sodu może powodować uszkodzenie wątroby i nerek, dlatego należy obchodzić się z nim ze szczególną ostrożnością (Departament Zdrowia stanu New Jersey, 2009).
W przypadku połknięcia ofiara powinna wypić wodę lub mleko; nigdy nie wywoływać wymiotów. W przypadku kontaktu ze skórą lub oczami należy go traktować jak oparzenia kwasem; płukać oczy wodą przez co najmniej 15 minut.
Uszkodzenia zewnętrzne można przetrzeć 2% roztworem tiosiarczanu sodu. We wszystkich przypadkach należy skonsultować się z lekarzem.
Zastosowania i aplikacje
Oprócz znaczenia w produkcji innych chemikaliów chromu, dwuchromian sodu ma również wiele bezpośrednich zastosowań jako składnik w produkcji:
- Metaliczne wykończenie: poprawia odporność na korozję i czyste powierzchnie metalowe, sprzyja również przyczepności farby.
- Produkty organiczne: używane jako utleniacze przy produkcji takich produktów, jak witamina K i wosk.
- Pigmenty: stosowane do produkcji nieorganicznych pigmentów chromianowych, gdzie dają gamę kolorów odpornych na światło. Niektóre gatunki chromianów są również stosowane jako inhibitory korozji w podkładach i podkładach..
- Ceramika: stosowana do wytwarzania kolorowych szkliw szklanych i ceramicznych.
- Tkanina: używana jako zaprawa do barwników kwasowych w celu wzmocnienia ich właściwości szybkiego barwienia.
- Produkcja siarczanu chromu.
(Dwuchromian sodu. Element budulcowy praktycznie wszystkich innych związków chromu., 2010-2012)
Dwuwodzian dichromianu sodu, idealny do stosowania w różnych warunkach, w tym w zastosowaniach wysokotemperaturowych, takich jak szkliwa ceramiczne i kolorowe szkło.
Tlenek chromu, który jest twardszy od innych tlenków metali, takich jak tytan czy żelazo, jest idealny do środowisk, w których temperatura i warunki procesu są agresywne.
Substancja ta jest wykorzystywana głównie do produkcji innych związków chromu, ale jest również wykorzystywana w szlamie bentonitowym wykorzystywanym do produkcji ropy naftowej, w środkach do konserwacji drewna, do produkcji chemikaliów organicznych oraz jako inhibitor korozji..
Po zmieszaniu z dichromianem glinowo-potasowym w procesie termicznym aluminium, tlenek chromu wytwarza metaliczny chrom o wysokiej czystości. Jest to niezbędny składnik do produkcji wysokowydajnych nadstopów stosowanych w przemyśle lotniczym..
W syntezie organicznej dwuchromian sodu jest stosowany jako utleniacz w reakcjach redukcji tlenków w obecności kwasu siarkowego..
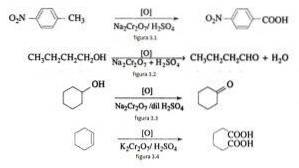
Na przykład utlenianie p-nitrotoluenu do kwasu p-nitrobenzoesowego, utlenianie n-butanolu do n-butaldehydu, tworzenie cykloheksanonu z cykloheksanolu i tworzenie kwasu adypinowego, jak zilustrowano na rysunkach 3.1, 3.2, 3.3 i 3.4 odpowiednio (VK Ahluwalia, 2004).
Biochemia
Dotchawicze wkroplenie dichromianu sodu (CrVI) i octanu chromu (CrIII) u samców szczurów powodowało zwiększenie stężenia chromu we krwi pełnej, osoczu i moczu do 72 godzin po ekspozycji; Maksymalne stężenie osiągnięto 6 godzin po ekspozycji..
Stosunek stężenia chromu w pełnej krwi do stężenia chromu w osoczu był znacząco różny w przypadku leczenia Cr (VI) i Cr (III). Dlatego do oceny narażenia na chrom należy stosować testy na obecność chromu we krwi i chrom w osoczu..
Chrom wykryto także w limfocytach obwodowych. Cr (VI), ale nie Cr (III), gromadził się znacząco w limfocytach po leczeniu. Komórki te mają potencjał do wykorzystania jako biomarkery w ocenie narażenia na związki chromu (Hooth, 2008).
Bibliografia
- Arkusz danych chemicznych Dichromian sodu. (2016). Pobrane z chemikaliów kamei: cameochemicals.noaa.
- Hooth, M. J. (2008). Technical Report on Toxicology and Carcinogenesis Studies of Sodium Dichromate Dihydrated. National Institute of Health USA.
- Kogel, J. E. (2006). Minerały przemysłowe i skały: towary, rynki i zastosowania, wydanie siódme. littleton colorado: stowarzyszenie górnictwa, metalurgii i eksploracji inc.
- Narodowe Centrum Informacji Biotechnologicznej. (s.f.). Baza danych PubChem Compound; CID = 25408. Pobrane z pubchem.com: pubchem.ncbi.nlm.nih.gov.
- Departament Zdrowia stanu New Jersey. (2009, listopad). zestawienie informacji o substancjach niebezpiecznych dwuchromian sodu. Odzyskane z nj.gov: nj.gov.
- Dichromian sodu. Element budulcowy praktycznie wszystkich innych związków chromu. (2010-2012). Pobrane z elementis chromium: elementischromium.com
- K. Ahluwalia, R. A. (2004). Kompleksowa praktyczna chemia organiczna: preparaty i analizy ilościowe. Delhi: University Press (Indie).



Jeszcze bez komentarzy