
Struktura dwusiarczku węgla (CS2), właściwości, zastosowania, zagrożenia
Plik disiarczek węgla Jest to związek utworzony przez połączenie atomu węgla (C) i dwóch atomów siarki (S). Jego wzór chemiczny to CSdwa. Jest bezbarwną lub lekko żółtą cieczą o nieprzyjemnym zapachu ze względu na zawarte w niej zanieczyszczenia (związki siarki). Kiedy jest czysty, ma miękki i słodki zapach, podobny do chloroformu lub eteru..
Pochodzi naturalnie z działania światła słonecznego na cząsteczki organiczne występujące w wodzie morskiej. Ponadto powstaje w wodach bagiennych, a także jest wydalany z wulkanów wraz z innymi gazami.
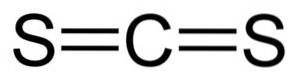
Dwusiarczek węgla jest lotną cieczą i jest również wysoce łatwopalny, dlatego należy go trzymać z dala od ognia i iskier lub urządzeń, które mogą je wytwarzać, nawet żarówek elektrycznych..
Posiada zdolność rozpuszczania dużej ilości związków, materiałów i pierwiastków, takich jak fosfor, siarka, selen, żywice, lakiery itp. Dlatego znajduje zastosowanie jako rozpuszczalnik.
Jest również pośrednikiem w różnych przemysłowych reakcjach chemicznych, takich jak produkcja sztucznego jedwabiu czy sztucznego jedwabiu..
Należy obchodzić się z nim ostrożnie i przy użyciu narzędzi ochronnych, ponieważ jest bardzo toksyczny i niebezpieczny.
Indeks artykułów
- 1 Struktura
- 2 Nazewnictwo
- 3 Właściwości
- 3.1 Stan fizyczny
- 3.2 Masa cząsteczkowa
- 3.3 Temperatura topnienia lub krzepnięcia
- 3.4 Temperatura wrzenia
- 3.5 Temperatura zapłonu
- 3.6 Temperatura samozapłonu
- 3.7 Gęstość
- 3.8 Prężność par
- 3.9 Rozpuszczalność
- 3.10 Właściwości chemiczne
- 4 Otrzymywanie
- 4.1 Obecność w przyrodzie
- 5 zastosowań
- 5.1 W przemyśle chemicznym
- 5.2 W produkcji sztucznego jedwabiu i celofanu
- 5.3 Przy produkcji czterochlorku węgla
- 5.4 W różnych zastosowaniach
- 5.5 Starożytne zastosowania
- 6 Ryzyka
- 7 Referencje
Struktura
Dwusiarczek węgla ma jeden atom węgla i dwa atomy siarki po obu stronach..
Wiązania między atomem węgla a atomami siarki są kowalencyjne i podwójne, dlatego są bardzo silne. Cząsteczka CSdwa ma strukturę liniową i symetryczną.

Nomenklatura
- Dwusiarczek węgla
- Dwusiarczek węgla
- Bezwodnik ditiowęglowodorowy
Nieruchomości
Stan fizyczny
Ciecz bezbarwna do żółtawej.
Waga molekularna
76,15 g / mol
Temperatura topnienia lub krzepnięcia
-110,8 ° C
Temperatura wrzenia
46,0 ºC
Temperatura zapłonu
-30 ºC (metoda zamkniętego tygla).
Temperatura samozapłonu
90 ° C
Gęstość
Ciecz = 1,26 g / cm3 przy 20 ºC.
Para = 2,67 razy większa niż powietrze.
Jego opary są ponad dwukrotnie cięższe od powietrza, a ciecz jest cięższa od wody.
Ciśnienie pary
279 mmHg w 25 ° C.
To jest wysokie ciśnienie pary.
Rozpuszczalność
Bardzo słabo rozpuszczalny w wodzie: 2,16 g / L przy 25 ° C. Rozpuszczalny w chloroformie. Mieszalny z etanolem, metanolem, eterem, benzenem, chloroformem i czterochlorkiem węgla.
Właściwości chemiczne
CSdwa łatwo odparowuje w temperaturze pokojowej, ponieważ jego temperatura wrzenia jest bardzo niska, a jego prężność par jest bardzo wysoka.
Dwusiarczek węgla jest wyjątkowo łatwopalny. Jego opary zapalają się bardzo łatwo, nawet pod wpływem ciepła żarówki elektrycznej. Oznacza to, że bardzo szybko reaguje z tlenem:
CSdwa + 3 Odwa → COdwa + 2 SOdwa
Fakt, że ma wysokie ciśnienie pary w temperaturze pokojowej, sprawia, że przebywanie w pobliżu płomienia jest niebezpieczne.
Po podgrzaniu w celu rozkładu może łatwo wybuchnąć, wydzielając toksyczne gazy tlenku siarki. Powyżej 90 ° C zapala się samorzutnie.
Rozkłada się, gdy jest przechowywany przez długi czas. Działa niszcząco na miedź i jej stopy. Reaguje również z niektórymi plastikami, gumami i powłokami.
W określonych warunkach reaguje z wodą, tworząc siarczek karbonylu OCS, dwutlenek węgla COdwa i disiarczek wodoru H.dwaS:
CSdwa + H.dwaO → OCS + HdwaS
CSdwa + 2 godzdwaO → COdwa + 2 godzdwaS
Z alkoholami (ROH) w środowisku zasadowym tworzy ksantoniany (RO-CS-SNa):
CSdwa + ROH + NaOH → HdwaO + RO-C (= S) -SNa
Otrzymywanie
Dwusiarczek węgla jest wytwarzany komercyjnie w reakcji siarki z węglem. Proces prowadzony jest w temperaturach 750-900 ° C.
C + 2 S → CSdwa
Zamiast węgla można również zastosować metan lub gaz ziemny, a nawet etan, propan i propylen, w którym to przypadku reakcja zachodzi w temperaturze 400-700 ° C z dużą wydajnością..
Można go również przygotować w reakcji gazu ziemnego z siarkowodorem H.dwaS w bardzo wysokiej temperaturze.
Obecność w przyrodzie
CSdwa jest to produkt naturalny obecny w atmosferze w bardzo małych ilościach (śladowe ilości). Jest produkowany fotochemicznie w wodach powierzchniowych.
Działanie światła słonecznego na niektóre związki obecne w wodzie morskiej, takie jak cysteina (aminokwas), prowadzi do powstania disiarczku węgla.

Jest również naturalnie uwalniany podczas erupcji wulkanów i występuje w niewielkich ilościach na bagnach..
Zwykle jesteśmy narażeni na wdychanie go w bardzo małych proporcjach i występuje on w niektórych produktach spożywczych. Występuje również w dymie papierosowym.
W środowisku rozkłada się pod wpływem światła słonecznego. Na ziemi porusza się przez nią. Niektóre mikroorganizmy w glebie ją rozkładają.
Aplikacje
W przemyśle chemicznym
Dwusiarczek węgla jest ważnym związkiem chemicznym, ponieważ jest używany do przygotowywania innych chemikaliów. Może działać jako półprodukt chemiczny.
Jest również używany jako rozpuszczalnik procesowy, na przykład do rozpuszczania fosforu, siarki, selenu, bromu, jodu, tłuszczów, żywic, wosków, lakierów i gum.
Pozwala m.in. na produkcję farmaceutyków i herbicydów.
W produkcji sztucznego jedwabiu i celofanu
Dzięki CSdwa Przygotowywane są ksantoniany, które są związkami używanymi do produkcji sztucznego jedwabiu i celofanu.
Aby uzyskać sztuczny jedwab lub sztuczny jedwab, stosuje się celulozę, którą traktuje się alkaliami i dwusiarczkiem węgla CSdwa i jest przekształcany w ksantogenian celulozy, rozpuszczalny w alkaliach. Ten roztwór jest lepki i dlatego nazywany jest „lepkim”.
Wiskoza jest przeciskana przez bardzo małe otwory w kąpieli kwasowej. Tutaj ksantogenian celulozy jest ponownie przekształcany w celulozę, która jest nierozpuszczalna i powstają długie i błyszczące nitki..
Nici lub włókna można przędzić w materiał znany jako sztuczny jedwab.
(1) Celuloza + NaOH → Celuloza alkaliczna
ROH + NaOH → RONa
(2) Celuloza alkaliczna + dwusiarczek węgla → ksantogenian celulozy
RONa + S = C = S → RO-C (= S) -SNa
(3) ksantogenian celulozy + kwas → celuloza (włókna)
RO-C (= S) -SNa + kwas → ROH

Jeśli celuloza jest wytrącana przez przepuszczenie ksantogenianu przez wąską szczelinę, celuloza jest regenerowana w postaci cienkich arkuszy, które tworzą celofan. Jest zmiękczany gliceryną i służy jako folia ochronna na przedmioty.

W produkcji czterochlorku węgla
Dwusiarczek węgla reaguje z chlorem Cldwa dając czterochlorek węgla CCl4, który jest ważnym niepalnym rozpuszczalnikiem.
CSdwa + 3 Cldwa → CCl4 + SdwaCldwa
W różnych zastosowaniach
Dwusiarczek węgla bierze udział w zimnej wulkanizacji kauczuków, służy jako półprodukt w produkcji pestycydów, jest wykorzystywany do generowania katalizatorów w przemyśle naftowym i produkcji papieru..
Ksantany przygotowane przy użyciu CSdwa są używane do flotacji minerałów.
Starożytne zastosowania
CSdwa jest trucizną dla żywych organizmów. Dawniej służył do niszczenia szkodników, takich jak szczury, świstaki i mrówki, wlewając płyn do każdej zamkniętej przestrzeni, w której żyły te zwierzęta (nory i mrowiska).
W tym celu gęste toksyczne opary zniszczyły każdy żywy organizm znajdujący się w zamkniętej przestrzeni..
Był również stosowany jako środek odrobaczający dla zwierząt oraz do usuwania larw muchówek z żołądka koni..
W rolnictwie był stosowany jako insektycyd i nematocyd, do odkażania gleby, do fumigacji szkółek, spichlerzy, silosów i młynów zbożowych. Spryskano również wagoniki, statki i barki.

Wszystkie te zastosowania były zabronione ze względu na wysoką palność i toksyczność CSdwa.
Ryzyka
CSdwa jest wysoce łatwopalny. Wiele z ich reakcji może spowodować pożar lub wybuch. Mieszaniny jego oparów z powietrzem są wybuchowe. Po zapaleniu wydziela drażniące lub toksyczne gazy.
Nie należy wylewać dwusiarczku węgla do kanalizacji, ponieważ w rurkach pozostaje mieszanina CSdwa oraz powietrze, które w przypadku przypadkowego zapłonu może spowodować wybuch.
Jego opary samorzutnie zapalają się w kontakcie z iskrami lub gorącymi powierzchniami.
Dwusiarczek węgla silnie drażni oczy, skórę i błony śluzowe.
Wdychany lub połknięty poważnie wpływa na centralny układ nerwowy, układ sercowo-naczyniowy, oczy, nerki i wątrobę. Może być również wchłaniany przez skórę, powodując uszkodzenia.
Bibliografia
- NAS. National Library of Medicine. (2020). Dwusiarczek węgla. Odzyskany z pubchem.ncbi.nlm.nih.gov.
- Mopper, K. i Kieber, D.J. (2002). Fotochemia i obieg węgla, siarki, azotu i fosforu. W biogeochemii morskiej rozpuszczonej materii organicznej. Odzyskany z sciencedirect.com.
- Meyer, B. (1977). Przemysłowe zastosowania siarki i jej związków. Dwusiarczek węgla. Siarka, energia i środowisko. Odzyskany z sciencedirect.com.
- Pohanish, R.P. (2012). C. Dwusiarczek węgla. W Sittig's Handbook of Toxic and Hazardous Chemicals and Carcinogens (wydanie szóste). Odzyskany z sciencedirect.com.
- Morrison, R.T. i Boyd, R.N. (2002). Chemia organiczna. 6th Edition. Prentice-Hall.
- Windholz, M. i in. (redaktorzy) (1983). Indeks Merck. Encyklopedia chemikaliów, leków i środków biologicznych. Wydanie dziesiąte. Merck & CO., Inc.



Jeszcze bez komentarzy