
Potencjalna energia jonizacji, metody oznaczania

Plik energia jonizacji odnosi się do minimalnej ilości energii, zwykle wyrażanej w kilodżulach na mol (kJ / mol), potrzebnej do oderwania elektronu znajdującego się w atomie fazy gazowej, który jest w stanie podstawowym.
Stan gazowy odnosi się do stanu, w którym jest wolny od wpływu, jaki inne atomy mogą wywierać na siebie, jak również wykluczone jest jakiekolwiek oddziaływanie międzycząsteczkowe. Wielkość energii jonizacji jest parametrem opisującym siłę, z jaką elektron wiąże się z atomem, którego jest częścią..
Innymi słowy, im większa jest wymagana ilość energii jonizacji, tym bardziej skomplikowane będzie odłączenie danego elektronu..
Indeks artykułów
- 1 Potencjał jonizacyjny
- 2 Metody wyznaczania energii jonizacji
- 3 Pierwsza energia jonizacji
- 4 Energia drugiej jonizacji
- 5 Referencje
Potencjał jonizacyjny
Potencjał jonizacyjny atomu lub cząsteczki definiuje się jako minimalną ilość energii, która musi być zastosowana, aby spowodować oderwanie się elektronu od najbardziej zewnętrznej powłoki atomu w jego stanie podstawowym i z ładunkiem obojętnym; to znaczy energia jonizacji.
Należy zauważyć, że mówiąc o potencjale jonizacyjnym, używa się terminu, który wyszedł z użycia. Dzieje się tak, ponieważ wcześniej określenie tej właściwości opierało się na wykorzystaniu potencjału elektrostatycznego do badanej próbki..
Dzięki wykorzystaniu tego potencjału elektrostatycznego nastąpiły dwie rzeczy: jonizacja związków chemicznych i przyspieszenie procesu uwalniania usuwanego elektronu..
Kiedy więc zaczęto używać technik spektroskopowych do jej określania, termin „potencjał jonizacji” został zastąpiony terminem „energia jonizacji”.
Podobnie wiadomo, że właściwości chemiczne atomów są określone przez konfigurację elektronów obecnych w tych atomach na najbardziej zewnętrznym poziomie energetycznym. Zatem energia jonizacji tych gatunków jest bezpośrednio związana ze stabilnością ich elektronów walencyjnych.
Metody wyznaczania energii jonizacji
Jak wspomniano wcześniej, metody określania energii jonizacji są głównie podawane przez procesy fotoemisji, które opierają się na określaniu energii emitowanej przez elektrony w wyniku zastosowania efektu fotoelektrycznego..
Chociaż można powiedzieć, że spektroskopia atomowa jest najbardziej bezpośrednią metodą określania energii jonizacji próbki, istnieje również spektroskopia fotoelektronów, w której mierzone są energie, z którymi elektrony są związane z atomami..
W tym sensie spektroskopia fotoelektronów w ultrafiolecie - znana również jako UPS ze swojego akronimu w języku angielskim - jest techniką, która wykorzystuje wzbudzenie atomów lub cząsteczek poprzez zastosowanie promieniowania ultrafioletowego..
Odbywa się to w celu analizy przejść energetycznych najbardziej zewnętrznych elektronów w badanych substancjach chemicznych i właściwości tworzonych przez nie wiązań..
Znana jest również rentgenowska spektroskopia fotoelektronów i ekstremalne promieniowanie ultrafioletowe, które wykorzystują tę samą zasadę opisaną wcześniej z różnicami w rodzaju promieniowania padającego na próbkę, szybkości, z jaką elektrony są wyrzucane i uzyskanej rozdzielczości.
Pierwsza energia jonizacji
W przypadku atomów, które mają więcej niż jeden elektron na swoim najbardziej zewnętrznym poziomie - czyli tzw. Atomy polielektroniczne - wartość energii niezbędnej do usunięcia pierwszego elektronu z atomu znajdującego się w stanie podstawowym podaje następujące równanie:
Energia + A (g) → A+(g) + e-
„A” symbolizuje atom dowolnego pierwiastka, a odłączony elektron jest reprezentowany jako „e-”. W ten sposób uzyskuje się pierwszą energię jonizacji, określaną jako „I1".
Jak widać, zachodzi reakcja endotermiczna, ponieważ do atomu dostarczana jest energia w celu uzyskania elektronu dodanego do kationu tego pierwiastka.
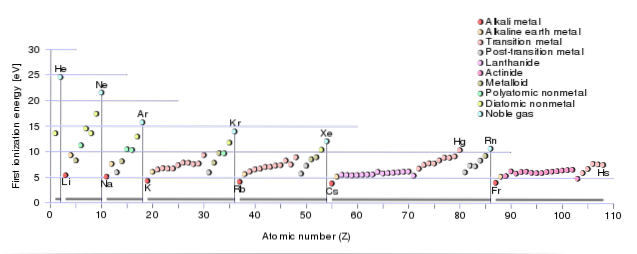
Podobnie wartość pierwszej energii jonizacji pierwiastków obecnych w tym samym okresie rośnie proporcjonalnie do wzrostu ich liczby atomowej..
Oznacza to, że zmniejsza się od prawej do lewej w okresie i od góry do dołu w tej samej grupie układu okresowego..
W tym sensie gazy szlachetne mają duże energie jonizacji, podczas gdy pierwiastki należące do metali alkalicznych i ziem alkalicznych mają niskie wartości tej energii..
Energia drugiej jonizacji
W ten sam sposób, gdy drugi elektron zostanie usunięty z tego samego atomu, uzyskuje się drugą energię jonizacji, symbolizowaną jako „Idwa".
Energia + A+(g) → Adwa+(g) + e-
Ten sam schemat jest stosowany dla innych energii jonizacji podczas uruchamiania kolejnych elektronów, wiedząc, że po oderwaniu się elektronu od atomu w jego stanie podstawowym zmniejsza się efekt odpychania występujący między pozostałymi elektronami..
Ponieważ właściwość zwana „ładunkiem jądrowym” pozostaje stała, do oderwania kolejnego elektronu z form jonowych, które mają ładunek dodatni, wymagana jest większa ilość energii. Więc energie jonizacji rosną, jak widać poniżej:
ja1 < Idwa < I3 <… < In
Wreszcie, oprócz wpływu ładunku jądrowego, na energie jonizacji wpływa konfiguracja elektronowa (liczba elektronów w powłoce walencyjnej, rodzaj zajmowanej orbity itp.) Oraz efektywny ładunek jądrowy odrzucanego elektronu..
Z powodu tego zjawiska większość cząsteczek o charakterze organicznym ma wysokie wartości energii jonizacji..
Bibliografia
- Chang, R. (2007). Chemia, wydanie dziewiąte. Meksyk: McGraw-Hill.
- Wikipedia. (s.f.). Energia jonizacji. Odzyskany z en.wikipedia.org
- Hiperfizyka. (s.f.). Energie jonizacji. Pobrane z hyperphysics.phy-astr.gsu.edu
- Field, F. H. i Franklin, J. L. (2013). Zjawiska uderzenia elektronów: i właściwości jonów gazowych. Odzyskany z books.google.co.ve
- Carey, F. A. (2012). Zaawansowana chemia organiczna: część A: struktura i mechanizmy. Uzyskane z books.google.co.ve

Jeszcze bez komentarzy