
Jednostki energii swobodnej Gibbsa, jak to obliczyć, rozwiązane ćwiczenia
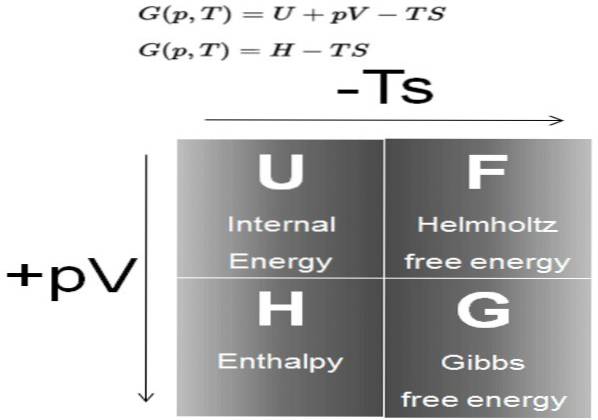
Plik Darmowa energia Gibbsa (potocznie nazywany G) jest potencjałem termodynamicznym definiowanym jako różnica entalpii H minus iloczyn temperatury T przez entropię S układu:
G = H - T S
Energię swobodną Gibbsa mierzy się w dżulach (zgodnie z systemem międzynarodowym), w ergach (w układzie jednostek dziesiętnych), w kaloriach lub w elektronowoltach (dla napięcia elektrycznego).
W procesach zachodzących przy stałym ciśnieniu i temperaturze zmiana energii swobodnej Gibbsa wynosi ΔG = ΔH - T ΔS. W takich procesach (G) reprezentuje energię dostępną w systemie, którą można przekształcić w pracę.
Na przykład w egzotermicznych reakcjach chemicznych entalpia spada, podczas gdy entropia wzrasta. W funkcji Gibbsa przeciwdziała się tym dwóm czynnikom, ale tylko wtedy, gdy energia Gibbsa spada, reakcja zachodzi spontanicznie..
Tak więc, jeśli wariacja G jest ujemna, proces jest spontaniczny. Kiedy funkcja Gibbsa osiąga minimum, układ osiąga stabilny stan równowagi. Podsumowując, w procesie, w którym ciśnienie i temperatura pozostają stałe, możemy stwierdzić:
- Jeśli proces jest spontaniczny, wówczas ΔG < 0
- Gdy system jest w równowadze: ΔG = 0
- W procesie niespontanicznym G wzrasta: ΔG> 0.
Indeks artykułów
- 1 Jak to jest obliczane?
- 1.1 - Krok po kroku
- 1.2 - Relacje termodynamiczne Maxwella
- 2 ćwiczenia rozwiązane
- 2.1 Ćwiczenie 1
- 2.2 Ćwiczenie 2
- 2.3 Ćwiczenie 3
- 3 Odnośniki
Jak to jest obliczane?
Energię swobodną Gibbsa (G) oblicza się według definicji podanej na początku:
G = H - T⋅S
Z kolei entalpia H jest potencjałem termodynamicznym zdefiniowanym jako:
H = U + P V
- Krok po kroku
Następnie zostanie przeprowadzona analiza krok po kroku, aby poznać zmienne niezależne, których funkcją jest energia Gibbsa:
1- Z pierwszej zasady termodynamiki wynika, że energia wewnętrzna U jest związana z entropią S układu i jego objętością V dla procesów odwracalnych poprzez zależność różniczkową:
dU = dQ - dW = TdS - PdV
Z tego równania wynika, że energia wewnętrzna U jest funkcją zmiennych S i V:
U = U (S, V)
2- Zaczynając od definicji H i biorąc różniczkę, otrzymujemy:
dH = dU + d (P V) = dU + VdP + PdV
3- Zastępując wyrażenie na dU otrzymane w (1) otrzymujemy:
dH = TdS - PdV + VdP + PdV = TdS + VdP
Z tego wynika, że entalpia H zależy od entropii S i ciśnienia P, to znaczy:
H = H (S, P)
4- Teraz oblicza się całkowitą różnicę energii swobodnej Gibbsa, uzyskując:
dG = dH -TdS -SdT = TdS + VdP -TdS -SdT
Gdzie dH zostało zastąpione wyrażeniem znalezionym w (3).
5- Wreszcie, upraszczając, otrzymujemy: dG = VdP - SdT, jest jasne, że energia swobodna G zależy od ciśnienia i temperatury T jako:
G = G (P, T)
- Relacje termodynamiczne Maxwella
Z analizy w poprzedniej sekcji wynika, że energia wewnętrzna układu jest funkcją entropii i objętości:
U = U (S, V)
Następnie różnica LUB będzie:
dU = ∂SU |V dS + ∂VU |S dV = TdS - PdV
Z tego częściowego wyrażenia pochodnego można wyprowadzić tak zwane zależności termodynamiczne Maxwella. Pochodne cząstkowe mają zastosowanie, gdy funkcja zależy od więcej niż jednej zmiennej i można je łatwo obliczyć, stosując twierdzenie z następnej sekcji.
Pierwszy związek Maxwella
∂VT |S = -∂SP |V
Aby dojść do tego związku, plik Twierdzenie Clairauta-Schwarza w sprawie pochodnych częściowych, który stwierdza, co następuje:
„Mieszane pochodne drugiego rzędu z wymienionymi zmiennymi są równe, o ile otrzymywane funkcje są ciągłe i różniczkowalne”.
Drugi związek Maxwella
Na podstawie tego, co pokazano w punkcie 3 poprzedniej sekcji:
H = H (S, P) i dH = TdS + VdP
Można go uzyskać:
∂P.T |S = ∂SV |P.
Podobnie postępujemy z energią swobodną Gibbsa G = G (P, T) oraz z darmową energią Helmholtza F = F (T, V) aby uzyskać pozostałe dwie zależności termodynamiczne Maxwella.

Cztery zależności termodynamiczne Maxwella
1- Związane z energią wewnętrzną U: ∂VT |S = -∂SP |V
2- Ten uzyskany z entalpii H: ∂P.T |S = ∂SV |P.
3- Związane z energią Helmholtza F: ∂TP |V = ∂VS |T
4- Powiązane z energią swobodną Gibbsa G: ∂TV |P. = -∂P.S |T
Rozwiązane ćwiczenia
Ćwiczenie 1
Oblicz zmianę wolnej energii Gibbsa dla 2 moli gazu doskonałego w temperaturze 300 K podczas izotermicznej ekspansji, która przenosi system z początkowej objętości 20 litrów do końcowej objętości 40 litrów.
Rozwiązanie
Przywołując definicję darmowej energii Gibbsa mamy:
G = H - T S
Wtedy skończona odmiana F będzie:
ΔG = ΔH - T ΔS, ponieważ ΔT = 0
W gazach doskonałych entalpia zależy tylko od ich temperatury bezwzględnej, ale ponieważ jest to proces izotermiczny, wówczas ΔH = 0 i ΔG = - T ΔS.
Dla gazów doskonałych zmiana entropii procesu izotermicznego wynosi:
ΔS = nR ln (Vdwa/ V1)
To, co odnosi się do przypadku tego ćwiczenia, pozostaje:
ΔS = 2 mole x 8,314 J / (K-mol) x ln (40 l / 20 l) = 11,53 J / K
Wtedy możemy uzyskać zmianę energii Helmholtza:
ΔG = - 300 K x 11,53 J / K = -3457,70 J.
Ćwiczenie 2
Biorąc pod uwagę, że energia swobodna Gibbsa jest funkcją temperatury i ciśnienia G = G (T, P); określić zmianę G podczas procesu, w którym temperatura się nie zmienia (izotermiczna) dla n moli jednoatomowego gazu doskonałego.
Rozwiązanie
Jak wykazano powyżej, zmiana energii Gibbsa zależy tylko od zmiany temperatury T i objętości V, więc jej nieskończenie mała zmienność jest obliczana zgodnie z:
dG = -SdT + VdP
Ale jeśli jest to proces, w którym temperatura jest stała, to dF = + VdP, więc skończona zmiana ciśnienia ΔP prowadzi do zmiany energii Gibbsa podanej przez:
ΔG = + ∫ VdP = + ∫ (n R T) dP / P = + n R T ln (ΔP)
Korzystając z równania gazu doskonałego:
P V = n R T
Podczas procesu izotermicznego zdarza się, że:
d (P V) = P dV + V dP = 0
To jest:
dP / P = - dV / V
Zatem powyższy wynik można zapisać jako funkcję zmiany objętości ΔV:
ΔG = + ∫ VdP = + ∫ (n R T) dP / P = - ∫ (n R T) dV / V = -n R T ln (ΔV)
Ćwiczenie 3
Biorąc pod uwagę następującą reakcję chemiczną:
Ndwa0 (g) + (3/2) Odwa (g) ↔️ 2 NOdwa (g) w temperaturze T = 298 K.
Znajdź zmianę energii swobodnej Gibbsa i wykorzystując otrzymany wynik, wskaż, czy jest to proces spontaniczny.
Rozwiązanie
Oto kroki:
- Krok pierwszy: entalpie reakcji
ΔHr = 2 * ΔH (NOdwa (g)) - ΔH (Ndwa0 (g)) = 2 * 33,2-81,6 = -15,2 kJ / mol
- Drugi krok: zmienność entropii reakcji
ΔSr = 2 * S (NOdwa (g)) - S (Ndwa0 (g)) - (3/2) S (Odwa (g)) = 2 * 240,1 - 220,1 - 1,5 * 205,2 = -47,7 J / (mol * K).
- Trzeci krok: wariacja w funkcji Gibbsa
Wartość ta określi równowagę między malejącą energią a rosnącą entropią, aby wiedzieć, czy ostatecznie reakcja jest spontaniczna, czy nie.
ΔGr = ΔHr - T ΔSr = -15,2 -298 * (- 47,7) = -985,4 J / mol
Ponieważ jest to ujemna zmiana energii Gibbsa, można wnioskować, że jest to reakcja spontaniczna w temperaturze 298 K = 25 ºC.
Bibliografia
- Kasztany E. Ćwiczenia darmowej energii. Odzyskany z: lidiaconlaquimica.wordpress.com.
- Cengel, rok 2012. Termodynamika. 7th Edition. Mcgraw hill.
- Libretexts. Darmowa energia Gibbsa. Źródło: chem.libretexts.org
- Libretexts. Co to są darmowe energie. Źródło: chem.libretexts.org
- Wikipedia. Darmowa energia Gibbsa. Odzyskany z: es.wikipedia.com
- Wikipedia. Darmowa energia Gibbsa. Odzyskany z: en.wikipedia.com



Jeszcze bez komentarzy