
Sigma Link Jak powstaje, charakterystyka i przykłady
Plik sigma link (reprezentowane jako σ) jest związkiem typu kowalencyjnego, który charakteryzuje się współdzieleniem dwóch elektronów, które występują między parą atomów, tworząc wspomniane wiązanie. Ponadto jest to rodzaj wiązania pojedynczego, w którym oba atomy są połączone przez dwa elektrony, tworząc pojedyncze wiązanie..
Kiedy dwa lub więcej atomów jest połączonych w celu utworzenia nowych związków molekularnych, są one połączone za pomocą dwóch rodzajów wiązań: jonowego i kowalencyjnego, których struktura zależy od tego, jak elektrony są podzielone między oba atomy biorące udział w tym sprzężeniu..
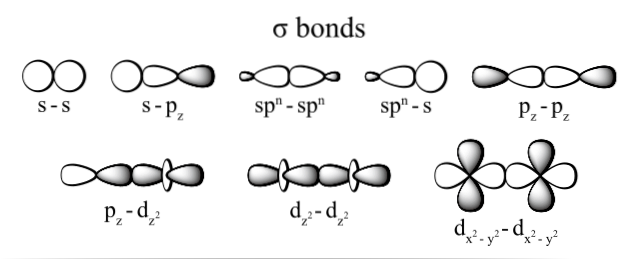
Połączenie generowane przez elektrony odbywa się dzięki zachodzeniu na siebie orbitali należących do każdego atomu (ich końcami), rozumiejąc jako orbitale przestrzenie, w których najprawdopodobniej lokalizuje elektron w atomie i które są definiowane przez elektron gęstość.
Indeks artykułów
- 1 Jak to się tworzy?
- 1.1 Tworzenie wiązań sigma w różnych gatunkach chemicznych
- 2 Funkcje
- 3 przykłady
- 4 Odnośniki
Jak to się tworzy?
Zwykle wiadomo, że pojedyncze wiązanie między dwoma atomami jest równoważne pojedynczemu wiązaniu sigma..
Podobnie, te wiązania powstają w wyniku superpozycji lub nakładania się w sposób frontalny, który zachodzi między końcami orbitali atomowych dwóch różnych atomów..
Te atomy, których orbitale zachodzą na siebie, muszą sąsiadować ze sobą, aby poszczególne elektrony należące do każdego orbitalu atomowego mogły skutecznie łączyć się i tworzyć wiązanie..
Stąd fakt, że rozkład elektronowy, który się objawia, lub lokalizacja gęstości elektronów z każdej superpozycji, ma cylindryczną symetrię wokół osi, która występuje między dwoma połączonymi cząsteczkami atomów..
W tym przypadku tak zwany orbital sigma można łatwiej wyrazić w kategoriach wiązań wewnątrzcząsteczkowych, które tworzą się w cząsteczkach dwuatomowych, zauważając, że istnieje również kilka rodzajów wiązań sigma..
Najczęściej obserwowanymi typami wiązań sigma są: dzdwa+rezdwa, s + pz, pz+pz i s + s; gdzie indeks dolny z przedstawia oś utworzoną przez utworzone wiązanie, a każda litera (s, p i d) odpowiada orbitalowi.
Tworzenie wiązań sigma w różnych gatunkach chemicznych
Mówiąc o orbitali molekularnych, odwołujemy się do regionów, które gromadzą największą gęstość elektronów, gdy wiązanie tego typu tworzy się między różnymi cząsteczkami, a uzyskuje się je dzięki połączeniu orbitali atomowych..
Z punktu widzenia mechaniki kwantowej badania wykazały, że orbitale typu molekularnego, które wykazują symetrycznie równe zachowanie, są w rzeczywistości łączone w mieszaniny (hybrydyzacje).
Jednak znaczenie tej kombinacji orbitali jest ściśle związane ze względnymi energiami manifestowanymi przez orbitale typu molekularnego, które są symetrycznie podobne..
W przypadku cząsteczek organicznych często obserwuje się związki cykliczne składające się z jednej lub więcej struktur pierścieniowych, które często tworzą duża liczba wiązań typu sigma w połączeniu z wiązaniami typu pi (wiązania wielokrotne)..
W rzeczywistości za pomocą prostych obliczeń matematycznych można określić liczbę wiązań sigma obecnych w cząsteczkach..
Istnieją również przypadki związków koordynacyjnych (z metalami przejściowymi), w których wiele wiązań jest połączonych z różnymi klasami oddziaływań wiążących, a także cząsteczki zbudowane z różnych typów atomów (wieloatomowe).
Charakterystyka
Wiązania Sigma mają unikalne cechy, które wyraźnie odróżniają je od innych typów wiązań kowalencyjnych (wiązanie pi), wśród których jest fakt, że ten typ wiązania jest najsilniejszy spośród wiązań chemicznych klasy kowalencyjnej.
Dzieje się tak, ponieważ nakładanie się orbitali zachodzi bezpośrednio, współosiowo (lub liniowo) i czołowo; to znaczy, uzyskuje się maksymalne nakładanie się orbitali.
Ponadto dystrybucja elektronów na tych skrzyżowaniach koncentruje się głównie między jądrami połączonych form atomowych..
To nakładanie się orbitali sigma zachodzi na trzy możliwe sposoby: między parą czystych orbitali (s-s), między czystym orbitalem a typem hybrydowym (s-sp) lub między parą orbitali typu hybrydowego (sp3- sp3).
Hybrydyzacja zachodzi dzięki mieszaninie orbitali pochodzenia atomowego różnych klas, uzyskując, że powstały orbital hybrydowy zależy od ilości każdego z typów czystych orbitali wyjściowych (np. Sp.3 = jeden czysty orbital s + trzy czyste orbitale typu p).
Oprócz tego wiązanie sigma może istnieć niezależnie, a także dopuszczać swobodny ruch obrotowy między parą atomów..
Przykłady
Ponieważ wiązanie kowalencyjne jest najpowszechniejszym rodzajem wiązania między atomami, wiązanie sigma występuje w ogromnej liczbie związków chemicznych, jak widać poniżej.
W dwuatomowych cząsteczkach gazów - takich jak wodór (H.dwa), tlen (Odwa) i azot (Ndwa) - w zależności od hybrydyzacji atomów mogą wystąpić różne typy wiązań.
W przypadku wodoru istnieje pojedyncze wiązanie sigma łączące oba atomy (H-H), ponieważ każdy atom wnosi swój jedyny elektron.
Z drugiej strony, w cząsteczkowym tlenie oba atomy są połączone podwójnym wiązaniem (O = O) - to znaczy wiązaniem sigma - i wiązaniem pi, pozostawiając każdemu atomowi sparowane trzy pary pozostałych elektronów.
Zamiast tego każdy atom azotu ma pięć elektronów na swoim najbardziej zewnętrznym poziomie energii (powłoka walencyjna), więc są one połączone potrójnym wiązaniem (N≡N), co oznacza obecność wiązania sigma i dwóch wiązań pi oraz pary sparowanych elektronów w każdym atomie.
Podobnie występuje w związkach typu cyklicznego z wiązaniami pojedynczymi lub wielokrotnymi oraz we wszystkich rodzajach cząsteczek, których struktura składa się z wiązań kowalencyjnych..
Bibliografia
- Wikipedia. (s.f.). Więź Sigma. Odzyskany z en.wikipedia.org
- Chang, R. (2007). Chemia, wydanie dziewiąte. Meksyk: McGraw-Hill.
- ThoughtCo. (s.f.). Definicja chemii Sigma Bond. Odzyskany z thinkco.com
- Britannica, E. (s.f.). Więź Sigma. Pobrane z britannica.com
- LibreTexts. (s.f.). Obligacje Sigma i Pi. Odzyskany z chem.libretexts.org
- Srivastava, A. K. (2008). Prosta chemia organiczna. Odzyskany z books.google.co.ve



Jeszcze bez komentarzy