
Charakterystyka i typy połączeń międzyatomowych

Plik połączyć międzyatomowy Jest to wiązanie chemiczne, które powstaje między atomami w celu wytworzenia cząsteczek. Chociaż dziś naukowcy ogólnie zgadzają się, że elektrony nie krążą wokół jądra, przez całą historię uważano, że każdy elektron krąży wokół jądra atomu w oddzielnej powłoce..
Dzisiaj naukowcy doszli do wniosku, że elektrony unoszą się nad określonymi obszarami atomu i nie tworzą orbit, jednak powłoka walencyjna jest nadal używana do opisu dostępności elektronów..
Linus Pauling przyczynił się do nowoczesnego rozumienia wiązania chemicznego, pisząc książkę „The Nature of Chemical Bonding”, w której zebrał pomysły od Sir Isaaca Newtona, Étienne François Geoffroy, Edwarda Franklanda, aw szczególności Gilberta N. Lewisa.
W nim połączył fizykę mechaniki kwantowej z chemiczną naturą interakcji elektronowych, które zachodzą podczas tworzenia wiązań chemicznych..
Praca Paulinga skupiała się na ustaleniu, że prawdziwe wiązania jonowe i wiązania kowalencyjne znajdują się na końcach spektrum wiązań i że większość wiązań chemicznych jest klasyfikowana między tymi skrajnościami..
Pauling dalej opracował przesuwną skalę typu wiązania, w której rządzi elektroujemność atomów zaangażowanych w wiązanie..
Ogromny wkład Paulinga w nasze współczesne rozumienie wiązań chemicznych doprowadził do przyznania mu w 1954 roku Nagrody Nobla za „badanie natury wiązań chemicznych i ich zastosowania do wyjaśnienia struktury złożonych substancji”.
Żywe istoty składają się z atomów, ale w większości przypadków atomy te nie tylko unoszą się pojedynczo. Zamiast tego normalnie oddziałują z innymi atomami (lub grupami atomów).
Na przykład atomy mogą być połączone silnymi wiązaniami i zorganizowane w cząsteczki lub kryształy. Lub mogą tworzyć tymczasowe, słabe wiązania z innymi atomami, które się z nimi zderzają..
Zarówno silne wiązania, które wiążą cząsteczki, jak i słabe wiązania, które tworzą tymczasowe połączenia, są niezbędne dla chemii naszych ciał i dla istnienia samego życia..
Atomy mają tendencję do układania się w najbardziej stabilne możliwe wzory, co oznacza, że mają tendencję do wypełniania lub wypełniania swoich najbardziej zewnętrznych orbit elektronów..
W tym celu łączą się z innymi atomami. Siła, która utrzymuje razem atomy w kolekcjach zwanych cząsteczkami, jest znana jako wiązanie chemiczne..
Rodzaje międzyatomowych wiązań chemicznych
Wiązanie metaliczne
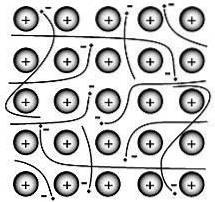
Wiązanie metaliczne to siła, która utrzymuje razem atomy w czystej metalicznej substancji. Taka bryła składa się z blisko upakowanych atomów.
W większości przypadków najbardziej zewnętrzna powłoka elektronowa każdego z atomów metalu zachodzi na dużą liczbę sąsiednich atomów. W konsekwencji elektrony walencyjne nieustannie przemieszczają się od atomu do atomu i nie są związane z żadną określoną parą atomów..
Metale mają kilka unikalnych cech, takich jak zdolność do przewodzenia prądu, niska energia jonizacji i niska elektroujemność (więc łatwo oddają elektrony, to znaczy są kationami)..
Ich właściwości fizyczne obejmują błyszczący (błyszczący) wygląd oraz są plastyczne i ciągliwe. Metale mają strukturę krystaliczną. Jednak metale są również kowalne i ciągliwe.
XX wieku Paul Drüde opracował teorię morza elektronów, modelując metale jako mieszaninę jąder atomowych (jądra atomowe = jądra dodatnie + wewnętrzna powłoka elektronowa) i elektronów walencyjnych..
W tym modelu elektrony walencyjne są wolne, zdelokalizowane, ruchome i niezwiązane z żadnym konkretnym atomem..
Wiązanie jonowe
Wiązania jonowe mają charakter elektrostatyczny. Występują, gdy element o ładunku dodatnim łączy się z elementem o ładunku ujemnym poprzez oddziaływania kulombowskie.
Pierwiastki o niskiej energii jonizacji mają tendencję do łatwego tracenia elektronów, podczas gdy pierwiastki o wysokim powinowactwie elektronowym mają tendencję do ich pozyskiwania, wytwarzając odpowiednio kationy i aniony, które tworzą wiązania jonowe..
Związki wykazujące wiązania jonowe tworzą kryształy jonowe, w których jony dodatnie i ujemnie naładowane oscylują blisko siebie, ale nie zawsze istnieje bezpośrednia korelacja 1-1 między jonami dodatnimi i ujemnymi..
Wiązania jonowe można zazwyczaj rozerwać poprzez uwodornienie lub dodanie wody do związku.
Substancje utrzymywane razem przez wiązania jonowe (takie jak chlorek sodu) mogą zwykle rozdzielać się na prawdziwie naładowane jony, gdy działają na nie siły zewnętrzne, na przykład rozpuszczone w wodzie..
Co więcej, w postaci stałej poszczególne atomy nie są przyciągane do pojedynczego sąsiada, ale zamiast tego tworzą gigantyczne sieci, które są przyciągane do siebie przez interakcje elektrostatyczne między jądrem każdego atomu a sąsiednimi elektronami walencyjnymi..
Siła przyciągania między sąsiednimi atomami nadaje jonowym ciałom stałym niezwykle uporządkowaną strukturę znaną jako sieć jonowa, w której przeciwnie naładowane cząstki ustawiają się w jednej linii, tworząc ściśle związaną sztywną strukturę..

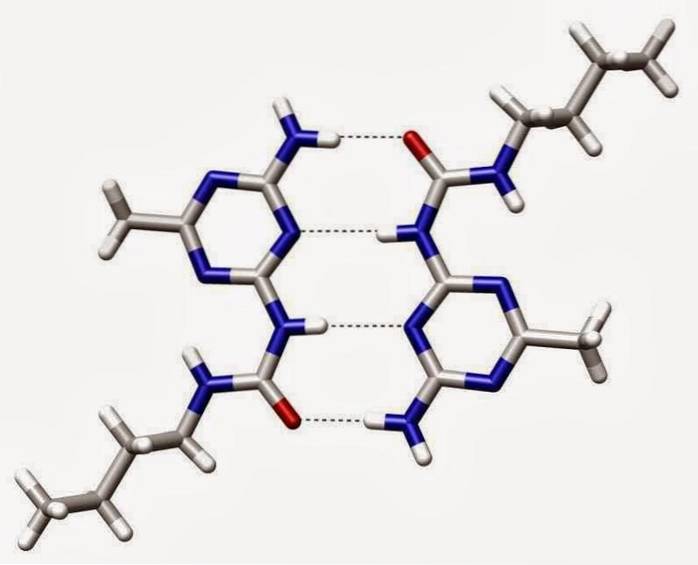
Wiązanie kowalencyjne
Wiązanie kowalencyjne występuje, gdy pary elektronów są wspólne dla atomów. Atomy połączą się kowalencyjnie z innymi atomami, aby uzyskać większą stabilność, którą uzyskuje się poprzez utworzenie pełnej powłoki elektronowej.
Dzieląc się swoimi najbardziej zewnętrznymi (walencyjnymi) elektronami, atomy mogą wypełnić swoją zewnętrzną powłokę elektronami i uzyskać stabilność..
Chociaż mówi się, że atomy dzielą elektrony, gdy tworzą wiązania kowalencyjne, często nie mają równych wspólnych elektronów. Tylko wtedy, gdy dwa atomy tego samego pierwiastka tworzą wiązanie kowalencyjne, wspólne elektrony są faktycznie dzielone równo między atomami..
Gdy atomy różnych pierwiastków mają wspólne elektrony poprzez wiązanie kowalencyjne, elektron zostanie przyciągnięty dalej w kierunku atomu o najwyższej elektroujemności, co spowoduje powstanie polarnego wiązania kowalencyjnego..
W porównaniu ze związkami jonowymi, związki kowalencyjne mają zwykle niższą temperaturę topnienia i wrzenia i rzadziej rozpuszczają się w wodzie..
Związki kowalencyjne mogą znajdować się w stanie gazowym, ciekłym lub stałym i nie przewodzą dobrze elektryczności ani ciepła..
Wiązania wodorowe
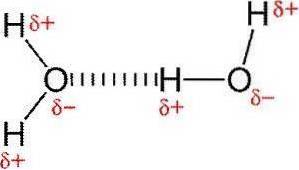
Wiązania wodorowe lub wiązania wodorowe to słabe interakcje między atomem wodoru przyłączonym do pierwiastka elektroujemnego z innym pierwiastkiem elektroujemnym.
W polarnym wiązaniu kowalencyjnym, które zawiera wodór (na przykład wiązanie O-H w cząsteczce wody), wodór będzie miał niewielki ładunek dodatni, ponieważ elektrony wiążące są przyciągane silniej w kierunku innego pierwiastka..
Z powodu tego niewielkiego ładunku dodatniego wodór będzie przyciągany do sąsiednich ładunków ujemnych..
Linki do Van der Waals
Są to stosunkowo słabe siły elektryczne, które przyciągają do siebie obojętne cząsteczki w gazach, gazach skroplonych i zestalonych oraz w prawie wszystkich cieczach organicznych i stałych..
Siły te zostały nazwane na cześć holenderskiego fizyka Johannesa Diderika van der Waalsa, który w 1873 po raz pierwszy postulował te siły międzycząsteczkowe przy opracowywaniu teorii wyjaśniającej właściwości gazów rzeczywistych..
Siły Van der Waalsa to ogólny termin używany do określenia przyciągania sił międzycząsteczkowych między cząsteczkami..
Istnieją dwie klasy sił Van der Waalsa: siły dyspersji londyńskiej, które są słabymi, i silniejsze siły dipolowo-dipolowe..
Bibliografia
- Anthony Capri, A. D. (2003). Wiązanie chemiczne: natura wiązania chemicznego. Pobrane z visionlearning visionlearning.com
- Camy Fung, N. M. (11 sierpnia 2015). Wiązania kowalencyjne. Zaczerpnięte z chem.libretexts chem.libretexts.org
- Clark, J. (25 lutego 2017). Klejenie metaliczne. Zaczerpnięte z chem.libretexts chem.libretexts.org
- Encyclopædia Britannica. (4 kwietnia 2016). Wiązanie metaliczne. Zaczerpnięte z britannica britannica.com.
- Encyclopædia Britannica. (16 marca 2016). Siły Van der Waalsa. Zaczerpnięte z britannica britannica.com
- Kathryn Rashe, L. P. (11 marca 2017). Siły Van der Waalsa. Zaczerpnięte z chem.libretexts chem.libretexts.org.
- Khan, S. (S.F.). Wiązania chemiczne. Zaczerpnięte z khanacademy khanacademy.org.
- Martinez, E. (24 kwietnia 2017). Co to jest wiązanie atomowe? Zaczerpnięte z sciencing sciencing.com.
- Wyzant, Inc. (S.F.). Więzy. Zaczerpnięty z wyzant wyzant.com.



Jeszcze bez komentarzy