
Widmo absorpcji absorpcja atomowa, widzialna i molekularna
ZA Widmo absorpcji Jest produktem interakcji światła z materiałem lub substancją w dowolnym stanie fizycznym. Ale definicja wykracza poza zwykłe światło widzialne, ponieważ interakcja obejmuje szeroki zakres długości fal i energii promieniowania elektromagnetycznego..
Dlatego niektóre ciała stałe, ciecze lub gazy mogą pochłaniać fotony o różnych energiach lub długościach fal; od promieniowania ultrafioletowego, po którym następuje światło widzialne, do promieniowania lub światła podczerwonego, przechodząc do długości fal mikrofalowych.

Oko ludzkie dostrzega tylko interakcje materii ze światłem widzialnym. Podobnie jest w stanie kontemplować dyfrakcję światła białego przez pryzmat lub ośrodek w jego kolorowych składnikach (górny obraz).
Gdyby promień światła został „złapany” po przejściu przez materiał i przeanalizowaniu, można by stwierdzić brak pewnych pasm kolorów; to znaczy, zaobserwowano by czarne pasy kontrastujące z tłem. To jest widmo absorpcyjne, a jego analiza ma fundamentalne znaczenie w instrumentalnej chemii analitycznej i astronomii..
Indeks artykułów
- 1 Absorpcja atomowa
- 1.1 Przemiany i energie elektroniczne
- 2 Widoczne widmo
- 3 Widmo absorpcyjne cząsteczek
- 3.1 Błękit metylenowy
- 3.2 Chlorofile a i b
- 4 Odnośniki
Absorpcja atomowa
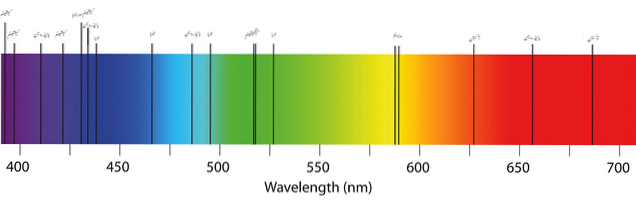
Górny obraz przedstawia typowe widmo absorpcji pierwiastków lub atomów. Zwróć uwagę, że czarne pasma reprezentują pochłonięte długości fal, podczas gdy pozostałe to emitowane. Oznacza to, że dla kontrastu, widmo emisji atomowej wyglądałoby jak czarne pasmo z pasami emitowanych kolorów..
Ale co to za paski? Skąd w skrócie wiedzieć, czy atomy pochłaniają, czy emitują (bez wprowadzania fluorescencji lub fosforescencji)? Odpowiedzi leżą w dozwolonych stanach elektronowych atomów.
Elektronowe przejścia i energie
Elektrony są w stanie oddalić się od jądra, pozostawiając je dodatnio naładowane podczas przechodzenia z orbity o niższej energii na orbitę o wyższej energii. W tym celu, wyjaśnione przez fizykę kwantową, pochłaniają one fotony o określonej energii, aby przeprowadzić wspomniane przejście elektroniczne..
Dlatego energia jest kwantowana i nie absorbują połowy lub trzech czwartych fotonu, ale określone wartości częstotliwości (ν) lub długości fal (λ).
Po wzbudzeniu elektron nie pozostaje przez nieograniczony czas w elektronicznym stanie wyższej energii; uwalnia energię w postaci fotonu, a atom wraca do stanu podstawowego lub pierwotnego.
W zależności od tego, czy zarejestrowano zaabsorbowane fotony, otrzymamy widmo absorpcyjne; a jeśli wyemitowane fotony zostaną zarejestrowane, wynikiem będzie widmo emisyjne.
Zjawisko to można zaobserwować eksperymentalnie, jeśli gazowe lub rozpylone próbki pierwiastka zostaną podgrzane. W astronomii, porównując te widma, można poznać skład gwiazdy, a nawet jej położenie względem Ziemi..
Widoczne widmo
Jak widać na dwóch pierwszych zdjęciach, widmo widzialne obejmuje kolory od fioletu do czerwieni i wszystkie ich odcienie, w zależności od tego, jak bardzo materiał pochłania (ciemne niuanse).
Długości fal światła czerwonego odpowiadają wartościom od 650 nm wzwyż (aż znikną w promieniowaniu podczerwonym). A po lewej stronie odcienie fioletu i fioletu pokrywają wartości długości fal do 450 nm. Widmo widzialne waha się wtedy w przybliżeniu od 400 do 700 nm.
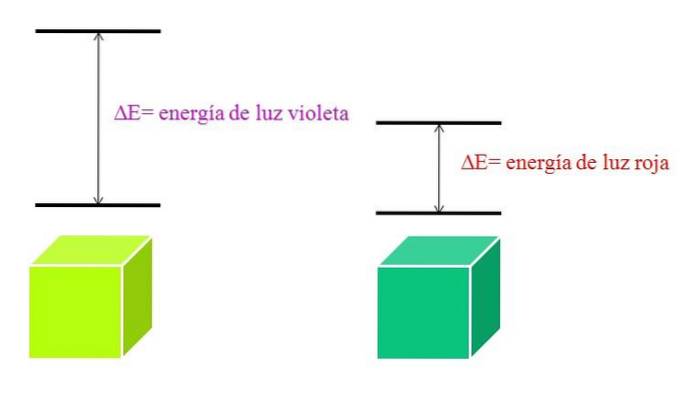
Wraz ze wzrostem λ maleje częstotliwość fotonu, a tym samym jego energia. Zatem światło fioletowe ma wyższą energię (krótsze długości fal) niż światło czerwone (dłuższe fale). Dlatego materiał, który pochłania fioletowe światło, zawiera przejścia elektroniczne wyższych energii..
A jeśli materiał wchłonie kolor fioletowy, jaki kolor będzie odbijał? Będzie miał zielonkawo-żółty kolor, co oznacza, że jego elektrony wykonują bardzo energetyczne przejścia; podczas gdy materiał absorbuje czerwony kolor o niższej energii, będzie odbijał niebieskawo-zielony kolor.
Kiedy atom jest bardzo stabilny, generalnie wykazuje bardzo odległe stany elektronowe energii; i dlatego będziesz musiał zaabsorbować fotony o wyższej energii, aby umożliwić przejścia elektroniczne:
Widmo absorpcyjne cząsteczek
Cząsteczki mają atomy, które również pochłaniają promieniowanie elektromagnetyczne; jednak ich elektrony są częścią wiązania chemicznego, więc ich przejścia są różne. Jednym z największych triumfów teorii orbitali molekularnych jest zdolność powiązania widm absorpcyjnych ze strukturą chemiczną.
Zatem pojedyncze, podwójne, potrójne, sprzężone wiązania i struktury aromatyczne mają swoje własne stany elektronowe; i dlatego pochłaniają bardzo specyficzne fotony.
Posiadając kilka atomów, oprócz oddziaływań międzycząsteczkowych i wibracji ich wiązań (które również pochłaniają energię), widma absorpcyjne cząsteczek mają postać „gór”, które wskazują pasma składające się na długości fal, w których zachodzą przejścia elektronowe.
Dzięki tym widmom związek można scharakteryzować, zidentyfikować, a nawet, za pomocą analizy wieloczynnikowej, określić ilościowo.
Błękit metylenowy
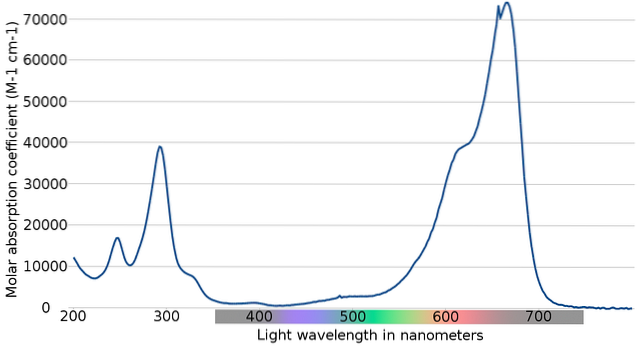
Górny obraz przedstawia widmo wskaźnika błękitu metylenowego. Jak wskazuje jego nazwa, jest koloru niebieskiego; ale czy można to zweryfikować za pomocą widma absorpcji?
Zauważ, że istnieją pasma między długościami fal 200 i 300 nm. Pomiędzy 400 a 500 nm prawie nie ma absorpcji, to znaczy nie absorbuje kolorów fioletowych, niebieskich ani zielonych.
Ma jednak silne pasmo absorpcji po 600 nm, a zatem ma niskoenergetyczne przejścia elektroniczne, które pochłaniają fotony światła czerwonego..
W konsekwencji, biorąc pod uwagę wysokie wartości chłonności molowych, błękit metylenowy wykazuje intensywnie niebieski kolor..
Chlorofile a i b
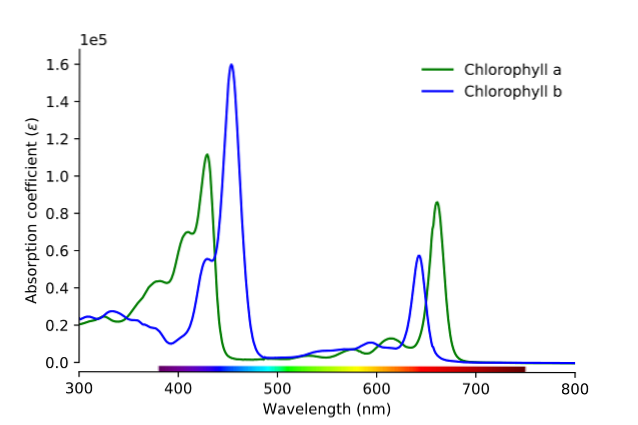
Jak widać na obrazku, zielona linia odpowiada widmowi absorpcji chlorofilu a, a niebieska odpowiada widmie chlorofilu b.
Po pierwsze, należy porównać prążki, w których chłonność molowa jest najwyższa; w tym przypadku te po lewej stronie, między 400 a 500 nm. Chlorofil a silnie absorbuje kolory fioletowe, podczas gdy chlorofil b (linia niebieska) absorbuje kolory niebieskie.
Absorbując chlorofil b około 460 nm, odbija się niebieski, żółty kolor. Z drugiej strony absorbuje również silnie w okolicach 650 nm światło pomarańczowe, co oznacza, że ma kolor niebieski. Jaki jest wynik mieszania się koloru żółtego i niebieskiego? Kolor zielony.
I wreszcie chlorofil a absorbuje niebiesko-fioletową barwę, a także czerwone światło w okolicach 660 nm. Dlatego wykazuje zielony kolor „zmiękczony” żółcią..
Bibliografia
- Observatoire de Paris. (s.f.). Różne klasy widm. Odzyskany z: media4.obspm.fr
- Kampus Uniwersytetu Rabanales. (s.f.). Spektrofotometria: widma absorpcyjne i kolorymetryczne oznaczanie ilościowe biocząsteczek. [PDF]. Odzyskany z: uco.es
- Day, R., & Underwood, A. (1986). Ilościowa chemia analityczna (wyd. piąte). PEARSON, Prentice Hall, s. 461–464.
- Reush W. (s.f.). Spektroskopia widzialna i ultrafioletowa. Odzyskane z: 2.chemistry.msu.edu
- David Darling. (2016). Widmo absorpcji. Odzyskany z: daviddarling.info
- Khan academy. (2018). Linie absorpcyjne / emisyjne. Odzyskane z: khanacademy.org

Jeszcze bez komentarzy