
Badanie kału, pobieranie próbek, techniki, przykłady
Plik Badanie stolca to badanie laboratoryjne polegające na badaniu kału (kału) w celu wykrycia pasożytów jelitowych. Jest to jedna z najprostszych i najstarszych technik laboratoryjnych, początkowo opracowana przez Antona Van Leeuwenhoeka w XVIII wieku..
Anton Van Leeuwenhoek, uważany za ojca mikrobiologii, zastosował „bezpośrednią” metodę współpasożytniczo-toskopową do obserwacji własnych odchodów i opisał, które lata później zostały zidentyfikowane jako trofozoity Giardia lamblia, pierwotniak, który atakuje jelito cienkie człowieka.
Choroby pasożytnicze dotykają miliony ludzi na świecie, zwłaszcza w krajach biednych lub słabo rozwiniętych, gdzie panują złe warunki sanitarne związane z usuwaniem odchodów i spożywaniem zanieczyszczonej wody..
Rozpoznanie tych schorzeń jest ważne dla prawidłowego leczenia, gdyż badanie koproparazytoskopowe jest w tym nieodzownym narzędziem. To proste, szybkie i niedrogie badanie laboratoryjne.
Badanie kału obejmuje kilka technik, które oprócz umożliwienia bezpośredniej wizualizacji i oceny ilościowej jaj, trofozoitów, cyst lub larw, umożliwiają identyfikację struktur mikroorganizmu, a tym samym identyfikację pasożyta..
Techniki stosowane do badania kału obejmują techniki barwienia błękitem metylenowym, metody koncentracji, technikę Fausta, technikę Richiego, techniki sedymentacyjne oraz badania bezpośrednie, pojedyncze lub seryjne..
Indeks artykułów
- 1 Pobieranie próbek
- 2 Techniki
- 2.1 Egzaminy bezpośrednie
- 2.2 Techniki zawieszania i zagęszczania
- 3 przykłady
- 4 Odnośniki
Próbowanie
Aby przeprowadzić to badanie, pacjentka musi pobrać świeżą próbkę stolca, która nie jest zanieczyszczona moczem, wodą, krwią (miesiączką) ani ziemią. Próbka musi mieć wielkość orzecha włoskiego lub, jeśli jest płynna, musi mieć co najmniej objętość odpowiadającą dwóm łyżkom stołowym.
Pacjent nie może przyjmować leków pasożytobójczych przez co najmniej trzy dni przed pobraniem próbki lub przez okres wskazany przez lekarza. Nie należy również stosować środków przeczyszczających.
Próbki należy umieszczać w suchym pojemniku z szeroką szyjką i pokrywką lub specjalnie zaprojektowanym pojemniku jednorazowym (dostępnym w preferowanej aptece). Próbki należy umieścić w chłodnym miejscu, nie przechowywać w lodówce dłużej niż 24 godziny i nie należy ich przechowywać w pobliżu źródeł ciepła ani zamrażać.
Gdy wskazane badanie jest seryjne, wymagane są co najmniej trzy próbki, które należy pobierać co 24 godziny lub dłużej, zgodnie z zaleceniami lekarza. W takich przypadkach laboratoria zazwyczaj zapewniają zestaw kolb zawierających roztwory z konserwantami..
Gdy pacjent zauważy w kale „robaka”, o ile to możliwe, powinien umieścić go w zamkniętej butelce z wodą i zabrać do laboratorium razem z butelką z próbką kału..
Fiolki z próbkami lub z „robakami” muszą być oznakowane i oznaczone imieniem i nazwiskiem pacjenta, jego wiekiem, płcią oraz datą i godziną pobrania próbki..
Bardzo ważne jest, aby odpowiednio poinstruować pacjenta o wszystkich tych aspektach pobierania próbek i obchodzenia się z nimi, ponieważ zależy to od tego, czy elementy, które mogą występować we wspomnianej próbce, pozostaną zdolne do obserwacji, identyfikacji i diagnozy..
Techniki
Istnieją bezpośrednie testy kału oraz techniki zawieszania i zatężania próbek, które są używane wielokrotnie, aby uniknąć fałszywie ujemnych wyników i obserwować znacznie czystsze próbki. Niektóre techniki barwienia są również wykorzystywane do identyfikacji niektórych pasożytów..
Egzaminy bezpośrednie
Bezpośrednie badanie stolca techniką upuść kolczyk, polega na rozcieńczeniu próbki kału roztworem fizjologicznym (0,9% NaCl) i umieszczeniu kropli tego roztworu we wklęsłości, w której znajduje się specjalny szkiełko służące do tego celu.
Po umieszczeniu kropli na szkiełku nakrywa się szkiełko nakrywkowe i obserwuje pod mikroskopem. Technika ta pozwala nam obserwować jaja i cysty, ale pozwala też na obserwację dowolnego elementu ruchomego, takiego jak wiciowce, larwy, trofozoity, orzęski itp..
Techniki zawieszania i koncentracji
Techniki zawiesinowe wykorzystują roztwór, który jest gęstszy niż obserwowane pierwiastki, dzięki czemu unoszą się one na powierzchni cieczy i mogą zostać zebrane, ponieważ pozostają skoncentrowane w powierzchniowej warstwie roztworu..
Ta technika ma tę zaletę, że pozwala uzyskać dość czystą próbkę zanieczyszczeń, ponieważ te, które są bardziej gęste, pozostają na dnie butelki. Względną wadą jest to, że roztwór kurczy się i deformuje mikroorganizmy w krótkim czasie.
Metody te nie są stosowane w przypadku jaj robaków pasożytniczych i tasiemców, ponieważ są one bardzo ciężkie i nie unoszą się w tych roztworach. Są szeroko stosowane do obserwacji pierwotniaków w ich postaci tropozoicznej lub w ich jajach oraz do obserwacji larw, np. Strongyloides stercoralis.
Inną szeroko stosowaną techniką, ponieważ nie powoduje deformacji mikroorganizmów w próbce, jest prosta i niedroga, jest technika sedymentacji formaliny..
Wśród technik koncentracji możemy przytoczyć jako przykład techniki Fausta i Richiego.
Różne techniki, które umożliwiają mikroskopową wizualizację jaj, larw lub innych elementów różnych pasożytów jelitowych, w połączeniu z technikami barwienia, pozwalają na identyfikację i diagnostykę tych chorób..
Przykłady
Następnie opisano przypadek kliniczny i pokazano kilka obrazów ilustrujących przydatność badania kału w diagnostyce i ocenie korzyści z leczenia..
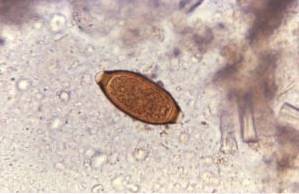
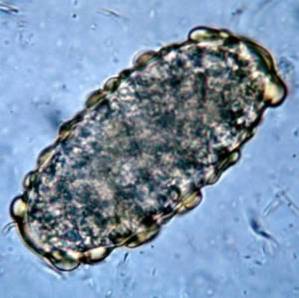
18-letni pacjent zgłasza się do gabinetu lekarskiego z powodu kolkowego bólu brzucha, nasilającego się w okolicy pępka, nudności i epizodów wodnistej biegunki.
Podczas przesłuchania pacjenta lekarz zwraca uwagę na dwa istotne punkty: 1) pacjent odnosi się do kąpieli w jeziorze na wsi i 2) uderza go fakt, że jego odchody unoszą się w toalecie. Po zbadaniu pacjenta lekarz podejrzewa obecność Giardia lamblia.
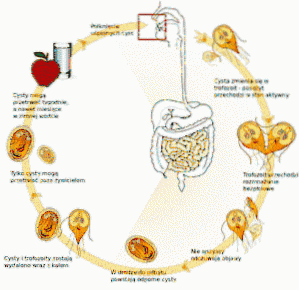
Ten pierwotniak żyje w jelicie cienkim człowieka i zaburza wchłanianie tłuszczów, co powoduje powstawanie bardzo tłustych stolców, które mają tendencję do unoszenia się na wodzie. Zanieczyszczenia często pochodzą z zanieczyszczonej wody w jeziorach lub strumieniach na obszarach wiejskich lub w basenach lub wannach z hydromasażem o złej konserwacji.
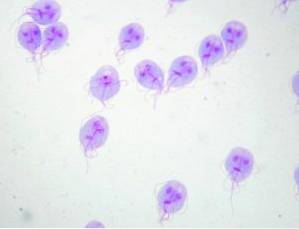
Lekarz wskazuje na badanie kału, a wyniki potwierdzają obecność Giardia lamblia. Po zakończeniu leczenia wskazane jest ponowne badanie kału potwierdzające brak cyst lub trofozoitów Giardia lamblia.
Bibliografia
- Buonfrate, D., Mena, M. A., Angheben, A., Requena-Mendez, A., Muñoz, J., Gobbi, F.,… & COHEMI Project Study Group. (2015). Występowanie strongyloidiasis w Ameryce Łacińskiej: systematyczny przegląd literatury. Epidemiologia i infekcja, 143(3), 452-460.
- de Haro Arteaga, I., & Ruiz, A. E. C. (2014). Diagnoza. Parazytologia medyczna (4, 347.
- Mendoza, D., Nunez, F. A., Escobedo, A. A., Pelayo, L., Fernandez, M., Torres, D., & Cordovi, R. A. (2003). Przydatność 2 metod koproparazytologicznych i ich wykorzystanie w badaniu terapeutycznym przeciwgrzybiczym. Kubański dziennik medycyny tropikalnej, 55(3), 174-178.
- Cena, -D. L. (2017). Instrukcja postępowania w diagnostyce pasożytów jelitowych. CRC Press.
- Sahin, I., Kiliç, H., Ozca, M., & Orhan, R. (1984). Badanie kopro-parazytologiczne na zapaśnikach reprezentacji narodowej. Mikrobiyoloji bülteni, 18(2), 114-118.



Jeszcze bez komentarzy