
Współczynnik ściśliwości, jak obliczać, przykłady i ćwiczenia
Plik współczynnik ściśliwości Z, lub współczynnik sprężania gazów to bezwymiarowa wartość (bez jednostek) wprowadzana jako poprawka do równania stanu gazów doskonałych. W ten sposób model matematyczny bardziej przypomina obserwowane zachowanie gazu..
W gazie idealnym równanie stanu odnoszące się do zmiennych P (ciśnienie), V (objętość) i T (temperatura) to: P.V ideał = n.R.T gdzie n = liczba moli, a R = idealna stała gazu. Dodając poprawkę na współczynnik ściśliwości Z, równanie to wygląda następująco:
P.V = Z.n.R.T
Indeks artykułów
- 1 Jak obliczyć współczynnik ściśliwości?
- 2 Przykłady
- 2.1 Współczynnik ściśliwości gazów doskonałych, powietrza, wodoru i wody
- 3 ćwiczenia rozwiązane
- 3.1 Ćwiczenie 1
- 3.2 Ćwiczenie 2
- 4 Odnośniki
Jak obliczyć współczynnik ściśliwości?
Biorąc pod uwagę, że objętość molowa wynosi Vchłodny = V / n, mamy prawdziwą objętość molową:
P. . Vreal = Z. R. T → Z = PV real/ RT
Ponieważ współczynnik ściśliwości Z zależy od warunków gazu, jest on wyrażony jako funkcja ciśnienia i temperatury:
Z = Z (P, T)
Porównując dwa pierwsze równania, można zauważyć, że jeśli liczba moli n jest równa 1, objętość molowa gazu rzeczywistego jest związana z objętością gazu doskonałego przez:
Vreal / Videał = Z → V real = Z Videał
Gdy ciśnienie przekroczy 3 atmosfery, większość gazów przestaje zachowywać się jak gazy idealne, a rzeczywista objętość znacznie różni się od idealnej.
Zostało to zrealizowane w jego eksperymentach przez holenderskiego fizyka Johannesa Van der Waalsa (1837-1923), co doprowadziło go do stworzenia modelu, który byłby lepiej dostosowany do praktycznych wyników niż idealne równanie gazu: równanie stanu Van. Der Waals.
Przykłady
Zgodnie z równaniem P.Vreal= Z.n.RT, Dla gazu doskonałego Z = 1. Jednak w rzeczywistych gazach wraz ze wzrostem ciśnienia rośnie wartość Z. Ma to sens, ponieważ im wyższe ciśnienie cząsteczki gazu mają więcej możliwości zderzenia, a zatem siły odpychania rosną i z nim głośność.
Z drugiej strony przy niższych ciśnieniach cząsteczki poruszają się swobodniej, a siły odpychania maleją. Dlatego oczekuje się niższej głośności. Jeśli chodzi o temperaturę, gdy rośnie, Z maleje.
Jak zauważył Van der Waals, w pobliżu tak zwanego punktu krytycznego zachowanie gazu znacznie odbiega od zachowania gazu doskonałego..
Punkt krytyczny (T.do, P.do) dowolnej substancji są wartościami ciśnienia i temperatury, które określają jej zachowanie przed zmianą fazy:
-Tdo to temperatura, powyżej której dany gaz nie przechodzi w stan ciekły.
-P.do minimalne ciśnienie wymagane do skroplenia gazu w temperaturze T.do
Każdy gaz ma jednak swój własny punkt krytyczny, określający temperaturę i obniżone ciśnienie T.r I pr następująco:
P.r = P / Pdo
Vr = V / Vdo
Tr = T / T.do
Obserwuje się, że zamknięty gaz ma identyczne Vr Y Tr wywiera taki sam nacisk P.r. Z tego powodu, jeśli Z jest wykreślane jako funkcja P.r sobie Tr, każdy punkt na tej krzywej jest taki sam dla dowolnego gazu. To się nazywa zasada odpowiednich stanów.
Współczynnik ściśliwości gazów doskonałych, powietrza, wodoru i wody
Poniżej znajduje się krzywa ściśliwości dla różnych gazów w różnych obniżonych temperaturach. Oto kilka przykładów Z dla niektórych gazów i procedura znajdowania Z za pomocą krzywej.
Gazy idealne
Gazy idealne mają Z = 1, jak wyjaśniono na początku.
Powietrze
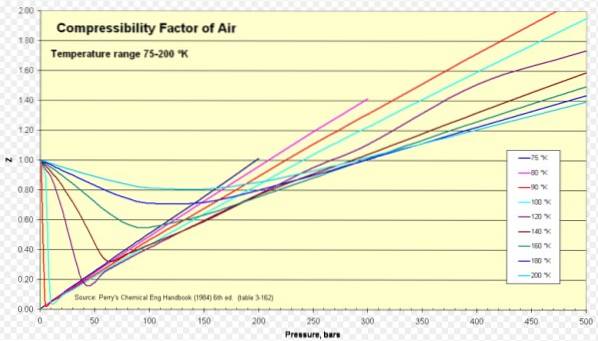
Dla powietrza Z wynosi około 1 w szerokim zakresie temperatur i ciśnień (patrz rysunek 1), gdzie idealny model gazu daje bardzo dobre wyniki.
Wodór
Z> 1 dla wszystkich ciśnień.
woda
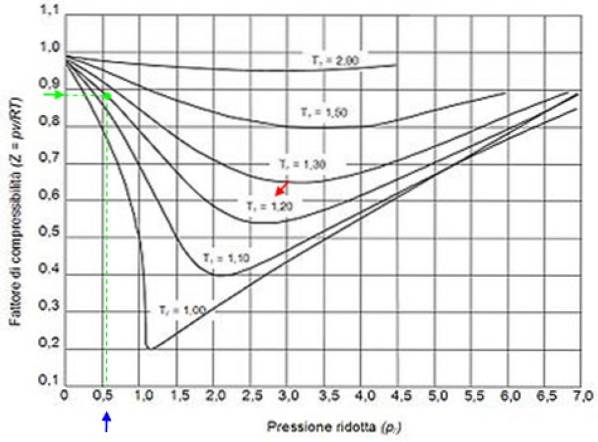
Aby znaleźć Z dla wody, potrzebujesz wartości punktów krytycznych. Punkt krytyczny wody to: P.do = 22,09 MPa i T.do= 374,14 ° C (647,3 K). Ponownie należy wziąć pod uwagę, że współczynnik ściśliwości Z zależy od temperatury i ciśnienia..
Na przykład, przypuśćmy, że chcesz znaleźć Z wody o temperaturze 500 ° C i 12 MPa. Następnie należy najpierw obliczyć temperaturę zredukowaną, dla której stopnie Celsjusza należy przeliczyć na kelwin: 50 ºC = 773 K:
Tr = 773 / 647,3 = 1,2
P.r = 12 / 22,09 = 0,54
Przy tych wartościach umieszczamy na wykresie krzywą odpowiadającą T.r = 1,2, zaznaczone czerwoną strzałką. Następnie szukamy wartości P na osi poziomejr bliżej 0,54, zaznaczone na niebiesko. Teraz rysujemy pion, aż przecinamy krzywą T.r = 1,2 i ostatecznie jest rzutowany z tego punktu na oś pionową, na której odczytujemy przybliżoną wartość Z = 0,89.
Rozwiązane ćwiczenia
Ćwiczenie 1
Istnieje próbka gazu o temperaturze 350 K i ciśnieniu 12 atmosfer, o objętości molowej o 12% większej niż przewidywana przez prawo gazu doskonałego. Oblicz:
a) Współczynnik kompresji Z.
b) Molowa objętość gazu.
c) Zgodnie z poprzednimi wynikami, wskazać dominujące siły w tej próbce gazu.
Dane: R = 0,082 L atm / mol.K
Rozwiązanie
Wiedząc, że V real jest o 12% większa niż Videał :
Vreal = 1,12 V.ideał
Z = V real / Videał = 1,12
Rozwiązanie b
P. Vreal = Z. R. T → Vreal = (1,12 x 0,082 x 350/12) L / mol = 2,14 L / mol.
Rozwiązanie c
Dominują siły odpychające, ponieważ objętość próbki wzrosła.
Ćwiczenie 2
W objętości 4,86 litra w temperaturze 27 ° C znajduje się 10 moli etanu. Znajdź ciśnienie wywierane przez etan z:
a) Idealny model gazu
b) Równanie van der Waalsa
c) Znajdź współczynnik kompresji z poprzednich wyników.
Dane dotyczące etanu
Współczynniki Van der Waalsa:
a = 5489 dm6. bankomat. kret-dwa i b = 0,06380 dm3. kret-1.
Ciśnienie krytyczne: 49 atm. Temperatura krytyczna: 305 K.
Rozwiązanie
Temperatura podana jest do kelwinów: 27 º C = 27 + 273 K = 300 K, pamiętaj również, że 1 litr = 1 L = 1 dm3.
Następnie podane dane są podstawiane do równania gazu doskonałego:
P.V = n.R.T → P = (10 x 0,082 x 300 / 4,86 L) atm = 50,6 atm
Rozwiązanie b
Równanie stanu Van der Waalsa to:
Gdzie a i b to współczynniki podane w instrukcji. Podczas rozliczania P:
Rozwiązanie c
Obliczamy obniżone ciśnienie i temperaturę:
P.r = 35,2 / 49 = 0,72
Tr = 300/305 = 0,98 ≈ 1
Mając te wartości, szukamy wartości Z na wykresie na rysunku 2, stwierdzając, że Z wynosi około 0,7.
Bibliografia
- Atkins, P. 1999. Physical Chemistry. Wydania Omega.
- Cengel, rok 2012. Termodynamika. 7mama Wydanie. Mcgraw hill.
- Engel, T. 2007. Wprowadzenie do fizykochemii: termodynamika. osoba.
- Levine, I. 2014. Zasady fizykochemii. 6th. Wydanie. Mcgraw hill.
- Wikipedia. Współczynnik ściśliwości. Odzyskane z: en.wikipedia.org.


Jeszcze bez komentarzy