
Czym jest hydroliza i przykłady reakcji

Plik hydroliza Jest to reakcja chemiczna, która może zachodzić zarówno w cząsteczkach nieorganicznych, jak i organicznych lub jonach, i wymaga udziału wody w celu zerwania ich wiązań. Jego nazwa pochodzi od greckiego „hydro” wody i „lysis” pęknięcia.
Cząsteczka wody, H.dwaLub ustanawia równowagę z jonami soli słabych kwasów i zasad, co pojawia się po raz pierwszy w ogólnych badaniach chemii i chemii analitycznej. Jest to zatem jedna z najprostszych reakcji chemicznych.
W kilku przykładach hydrolizy sama woda nie jest w stanie zerwać pewnego wiązania kowalencyjnego. Kiedy tak się dzieje, proces jest przyspieszany lub katalizowany przez zakwaszenie lub alkalizację medium; to znaczy w obecności jonów H.3LUB+ u OH-, odpowiednio. Podobnie istnieją enzymy, które katalizują hydrolizę.
Hydroliza zajmuje szczególne miejsce, jeśli chodzi o biocząsteczki, ponieważ wiązania łączące ich monomery są podatne na hydrolizę w określonych warunkach. Na przykład cukry są hydrolizowane w celu rozbicia polisacharydów na ich składowe monosacharydy dzięki działaniu enzymów glukozydazy.
Indeks artykułów
- 1 Co to jest hydroliza?
- 2 Przykłady reakcji hydrolizy
- 2.1 - ATP
- 2.2 - Woda
- 2.3 - Białka
- 2.4 - Amidy i estry
- 2,5 - Zasada kwasowa
- 3 Odnośniki
Co to jest hydroliza?
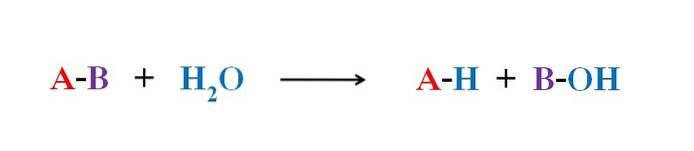
Powyższy obrazek wyjaśnia, z czego składa się hydroliza. Zwróć uwagę, że nie tylko cząsteczka lub substrat (jeśli pośredniczą enzymy) przerywa swoje wiązanie, ale także sama woda, która „pęka” na H+ i OH-, gdzie H.+ kończy się na A i OH- z B. A-B reaguje zatem z cząsteczką wody, tworząc dwa produkty, A-H i B-OH.
Hydroliza jest zatem reakcją odwrotną do kondensacji. W kondensacji dwa produkty, powiedzmy A-H i B-OH, łączą się poprzez uwolnienie małej cząsteczki: wody. Podczas hydrolizy cząsteczka jest zużywana, podczas kondensacji jest uwalniana lub produkowana.
Wracając do przykładu cukrów, załóżmy, że A-B odpowiada dimerowi sacharozy, gdzie A oznacza glukozę, a B oznacza fruktozę. Wiązanie A-B, glikozydowe, może ulegać hydrolizie w celu wytworzenia dwóch monosacharydów oddzielnie iw roztworze, i to samo dzieje się z oligo i polisacharydami, jeśli w takich reakcjach pośredniczą enzymy.
Zauważ, że w tej reakcji, A-B, strzałka ma tylko jeden kierunek; to znaczy jest to nieodwracalna hydroliza. Jednak wiele hydrolizy to w rzeczywistości reakcje odwracalne, które osiągają równowagę.
Przykłady reakcji hydrolizy
- ATP
ATP jest stabilny między wartościami pH 6,8 i 7,4. Jednak przy ekstremalnych wartościach pH hydrolizuje samorzutnie. U istot żywych hydroliza jest katalizowana przez enzymy znane jako ATPazy:
ATP + H.dwaO => ADP + Pi
Ta reakcja jest silnie egzergoniczna, ponieważ entropia ADP jest większa niż ATP. Wahania energii swobodnej Gibbsa (ΔGº) wynosi - 30,5 kJ / mol. Energia wytwarzana w wyniku hydrolizy ATP jest wykorzystywana w wielu reakcjach endergonicznych.
Reakcje sprzężone
W niektórych przypadkach hydroliza ATP służy do konwersji związku (A) w związek (B).
A + ATP + H.dwaLUB <=> B + ADP + Pi + H.+
- woda
Dwie cząsteczki wody mogą reagować ze sobą w pozornej hydrolizie:
H.dwaO + HdwaLUB <=> H.3LUB+ + O-
To tak, jakby jedna z tych cząsteczek wody rozpadła się na H.+ i OH-, zamierzam połączyć H+ do atomu tlenu innej cząsteczki wody, co powoduje powstanie jonu hydroniowego, H3LUB+. Ta reakcja, bardziej niż hydroliza, dotyczy autojonizacji lub autoprotolizy wody.
- Białko
Białka są stabilnymi makrocząsteczkami i aby osiągnąć ich całkowitą hydrolizę, w składających się na nie aminokwasach wymagane są ekstremalne warunki; takie jak stężenie kwasu solnego (6 M) i wysokie temperatury.
Jednak żywe istoty są wyposażone w enzymatyczny arsenał, który umożliwia hydrolizę białek do aminokwasów w dwunastnicy. Enzymy biorące udział w trawieniu białek są prawie całkowicie wydzielane przez trzustkę.
Istnieją enzymy egzopeptydazy, które rozkładają białka, zaczynając na ich końcach: aminopeptydaza na końcu aminowym i karboksypeptydaza na końcu karboksylowym. Enzymy endopeptydazy wywierają swoje działanie wewnątrz łańcucha białkowego, na przykład: trypsyna, pepsyna, chymotrypsyna itp..
- Amidy i estry
Amidy po podgrzaniu w środowisku zasadowym powodują powstanie kwasu karboksylowego i aminy:
RCONHdwa + H.dwaO => RCOO- + NHdwa
Estry w środowisku wodnym są hydrolizowane do kwasu karboksylowego i alkoholu. Proces jest katalizowany przez zasadę lub kwas:
RCO-OR '+ HdwaO => RCOOH + R'OH
To jest słynna reakcja zmydlenia.
- Kwasowo-zasadowy
W wodzie hydrolizuje się kilka gatunków w celu zakwaszenia lub alkalizacji środowiska wodnego.
Dodanie soli zasadowej
Octan sodu, sól zasadowa, dysocjuje w wodzie, dając jony Na+ (sód) i CH3GRUCHAĆ- (octan). Jego zasadowość wynika z faktu, że octan jest hydrolizowany z wytworzeniem jonów OH-, podczas gdy sód pozostaje niezmieniony:
CH3GRUCHAĆ- + H.dwaLUB <=> CH3COOH + OH-
OH- jest odpowiedzialny za wzrost i zasadowość pH.
Dodanie soli kwaśnej
Chlorek amonu (NH4Cl) jest tworzony przez jon chlorkowy (Cl-) z kwasu solnego (HCl), mocnego kwasu i kationu amonowego (NH4+) z wodorotlenku amonu (NH4OH), słaba zasada. Cl- W wodzie nie dysocjuje, ale kation amonu przekształca się w wodę w następujący sposób:
NH4+ + H.dwaLUB <=> NH3 + H.3LUB+
Hydroliza kationu amonowego wytwarza protony, które zwiększają kwasowość środowiska wodnego, więc wyciągnięto wniosek, że NH4Cl jest solą kwaśną.
Dodanie neutralnej soli
Chlorek sodu (NaCl) jest solnym produktem reakcji mocnej zasady (NaOH) z mocnym kwasem (HCl). Rozpuszczając chlorek sodu w wodzie, kation sodu (Na+) i anion (Cl-). Oba jony nie dysocjują w wodzie, więc nie dodają H.+ u OH-, utrzymywanie stałego pH.
Dlatego mówi się, że chlorek sodu jest solą obojętną..
Bibliografia
- Mathews, C. K., van Holde, K. E. and Ahern, K. G. (2002). Biochemia. (Trzecia edycja). Edytować. Pearson-Addison Wesley.
- Whitten, Davis, Peck & Stanley. (2008). Chemia. (8th ed.). CENGAGE Learning.
- Helmenstine, dr Anne Marie (13 stycznia 2019). Hydroliza: definicja i przykłady. Odzyskany z: thinkco.com
- Theresa Phillips. (28 kwietnia 2019). Wyjaśnienie procesu hydrolizy. Odzyskany z: thebalance.com
- Redaktorzy Encyclopaedia Britannica. (16 listopada 2016). Hydroliza. Encyclopædia Britannica. Odzyskany z: britannica.com
- Wikipedia. (2019). Hydroliza. Odzyskane z: en.wikipedia.org
Jeszcze bez komentarzy