
Wzór i jednostki prawa gazu doskonałego, zastosowania, przykłady
Plik prawo gazu doskonałego jest równaniem stanu opisującym zależność między funkcjami stanu związanymi z gazem doskonałym; takie jak temperatura, ciśnienie, objętość i liczba moli. Prawo to umożliwia badanie rzeczywistych układów gazowych poprzez porównanie ich z ich wyidealizowanymi wersjami..
Gaz doskonały to gaz teoretyczny, złożony z punktowych lub kulistych cząstek, które poruszają się losowo; o dużej energii kinetycznej, gdzie jedyną interakcją między nimi są wstrząsy całkowicie elastyczne. Ponadto są zgodne z prawem gazu doskonałego.

Przy standardowym ciśnieniu i temperaturze (STP): 1 atm ciśnienia i temperaturze 0 ºC większość rzeczywistych gazów zachowuje się jakościowo jak gazy idealne; o ile ich gęstość jest niska. Takie przybliżenia ułatwiają duże odległości międzycząsteczkowe lub międzyatomowe (dla gazów szlachetnych)..
W warunkach STP tlen, azot, wodór, gazy szlachetne i niektóre gazy w postaci związków, takie jak dwutlenek węgla, zachowują się jak gaz idealny..
Model gazu doskonałego ma tendencję do zawodzenia w niskich temperaturach, wysokich ciśnieniach i przy dużej gęstości cząstek; gdy istotne stają się interakcje międzycząsteczkowe, a także wielkość cząstek.
Prawo gazu doskonałego składa się z trzech praw gazowych: prawa Boyle'a i Mariotte'a, prawa Charlesa i Gay-Lussaca oraz prawa Avogadro..
Indeks artykułów
- 1 Formuła i jednostki
- 2 Co ustala prawo gazu doskonałego?
- 3 Aplikacje
- 3.1 Obliczanie gęstości i masy molowej gazu
- 3.2 Obliczanie objętości gazu powstającego w reakcji chemicznej
- 3.3 Obliczanie ciśnień cząstkowych gazów obecnych w mieszaninie
- 3.4 Objętość gazów zebranych w wodzie
- 4 Przykłady obliczeń
- 4.1 Ćwiczenie 1
- 4.2 Ćwiczenie 2
- 4.3 Ćwiczenie 3
- 4.4 Ćwiczenie 4
- 5 Referencje
Formuła i jednostki

Prawo gazowe wyraża się matematycznie wzorem:
PV = nRT
Gdzie P to ciśnienie wywierane przez gaz. Zwykle jest wyrażany za pomocą jednostki atmosfery (atm), chociaż można go wyrazić w innych jednostkach: mmHg, pascal, bar itp..
Objętość V zajmowana przez gaz jest zwykle wyrażana w litrach (L). Podczas n to liczba moli, R to uniwersalna stała gazowa, a T to temperatura wyrażona w kelwinach (K).
Najczęściej używanym wyrażeniem w gazach dla R jest 0,08206 L atm K.-1Kret-1. Chociaż jednostka SI dla stałej gazowej ma wartość 8,3145 J mol-1K.-1. Oba są ważne, o ile zadbano o jednostki innych zmiennych (P, T i V).
Prawo gazu doskonałego jest połączeniem prawa Boyle'a-Mariotte'a, prawa Charlesa-Gay-Lussaca i prawa Avogadro.
Prawo Boyle'a-Mariotte'a
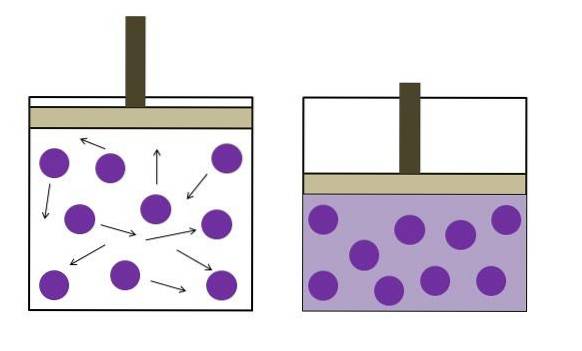
Został on sformułowany niezależnie przez fizyka Roberta Boyle'a (1662) oraz fizyka i botanika Edme Mariotte (1676). Prawo jest następujące: przy stałej temperaturze objętość ustalonej masy gazu jest odwrotnie proporcjonalna do wywieranego przez nią ciśnienia.
PV ∝ k
Używając dwukropka:
P.1V1 = PdwaVdwa
Prawo Charlesa-Gay-Lussaca

Prawo zostało opublikowane przez Gay-Lussaca w 1803 r., Ale zawierało odniesienie do niepublikowanej pracy Jacquesa Charlesa (1787). Z tego powodu prawo to jest znane jako prawo Karola..
Prawo mówi, że przy stałym ciśnieniu istnieje bezpośrednia proporcjonalna zależność między objętością zajmowaną przez gaz a jego temperaturą.
V ∝ kdwaT
Używając dwukropka:
V1/ T1 = Vdwa/ Tdwa
V1Tdwa = VdwaT1
Prawo Avogadro
Prawo zostało ogłoszone przez Amadeo Avogadro w 1811 roku, wskazując, że równe objętości wszystkich gazów, przy tym samym ciśnieniu i temperaturze, mają taką samą liczbę cząsteczek.
V1/ n1 = Vdwa/ ndwa
Co stanowi prawo dotyczące gazu doskonałego?
Prawo gazu doskonałego ustanawia związek między czterema niezależnymi właściwościami fizycznymi gazu: ciśnieniem, objętością, temperaturą i ilością gazu. Wystarczy znać wartość trzech z nich, aby móc uzyskać wartość pozostałych.
Prawo określa warunki, które wskazują, kiedy gaz zachowuje się idealnie i kiedy oddala się od tego zachowania.
Na przykład tak zwany współczynnik sprężania (PV / nRT) ma wartość 1 dla gazów doskonałych. Odejście od wartości 1 dla współczynnika sprężania wskazuje, że zachowanie gazu jest dalekie od tego, jakie wykazuje gaz doskonały.
Dlatego popełnionoby błąd, stosując równanie gazu doskonałego do gazu, który nie zachowuje się zgodnie z modelem.
Aplikacje
Obliczanie gęstości i masy molowej gazu
Równanie prawa gazu doskonałego można wykorzystać do obliczenia gęstości gazu i jego masy molowej. Dokonując prostej modyfikacji, można znaleźć wyrażenie matematyczne, które wiąże gęstość (d) gazu i jego masę molową (M):
d = MP / RT
I wyczyszczenie M:
M = dRT / P
Obliczanie objętości gazu powstającego w reakcji chemicznej
Stechiometria to dziedzina chemii, która odnosi się do ilości każdego z reagentów obecnych w produktach biorących udział w reakcji chemicznej, zwykle wyrażanej w molach..
Zastosowanie równania gazu doskonałego pozwala na określenie objętości gazu powstającego w reakcji chemicznej; ponieważ liczbę moli można uzyskać w wyniku reakcji chemicznej. Następnie można obliczyć objętość gazu:
PV = nRT
V = nRT / P
Mierząc V można określić wydajność lub postęp wspomnianej reakcji. Gdy nie ma już gazów, oznacza to, że odczynniki są całkowicie wyczerpane.
Obliczanie ciśnień cząstkowych gazów obecnych w mieszaninie
Prawo gazu doskonałego może być użyte razem z prawem ciśnienia cząstkowego Daltona do obliczenia ciśnień cząstkowych różnych gazów obecnych w mieszaninie gazów..
Relacja dotyczy:
P = nRT / V
Aby znaleźć ciśnienie każdego z gazów obecnych w mieszaninie.
Objętość gazów zebranych w wodzie
Prowadzona jest reakcja, w wyniku której powstaje gaz, który jest zbierany w sposób eksperymentalny w wodzie. Znane jest całkowite ciśnienie gazu plus ciśnienie pary wodnej. Wartość tego ostatniego można uzyskać w tabeli i odejmując ciśnienie gazu można obliczyć.
Ze stechiometrii reakcji chemicznej można obliczyć liczbę moli gazu i stosując zależność:
V = nRT / P
Obliczana jest objętość wyprodukowanego gazu.
Przykłady obliczeń
Ćwiczenie 1
Gaz ma gęstość 0,0847 g / l w 17 ° C i ciśnienie 760 torów. Jaka jest jego masa molowa? Co to jest gaz?
Zaczynamy od równania
M = dRT / P
Najpierw przeliczamy jednostki temperatury na kelwiny:
T = 17 ° C + 273,15 K = 290,15 K.
A ciśnienie 760 torów odpowiada ciśnieniu 1 atm. Teraz wystarczy podstawić wartości i rozwiązać:
M = (0,0847 g / l) (0,08206 l atm K-1Kret-1) (290,15 K) / 1 atm
M = 2,016 g / mol
Ta masa molowa może odpowiadać pojedynczemu rodzajowi: dwuatomowej cząsteczce wodoru, H.dwa.
Ćwiczenie 2
Masa 0,00553 g rtęci (Hg) w fazie gazowej znajduje się w objętości 520 L i w temperaturze 507 K. Obliczyć ciśnienie wywierane przez Hg. Masa molowa Hg wynosi 200,59 g / mol.
Problem rozwiązuje się za pomocą równania:
PV = nRT
Informacja o liczbie moli Hg nie pojawia się; ale można je otrzymać używając ich masy molowej:
Liczba moli Hg = (0,00553 g Hg) (1 mol Hg / 200,59 g)
= 2,757 10-5 pieprzyki
Teraz musimy tylko znaleźć P i podstawić wartości:
P = nRT / V
= (2,757 10-5 moli) (8,20610-dwa L atm K.-1Kret-1) (507 K) / 520 L.
= 2,2 10-6 bankomat
Ćwiczenie 3
Obliczyć ciśnienie wytworzone przez kwas solny powstały w reakcji 4,8 g gazowego chloru (Cldwa) z wodorem (H.dwa) o objętości 5,25 L i temperaturze 310 K. Masa molowa Cldwa wynosi 70,9 g / mol.
H.2 g) + Cl2 g) → 2 HCl(sol)
Problem rozwiązuje się za pomocą równania gazu doskonałego. Ale ilość HCl jest wyrażona w gramach, a nie w molach, więc odpowiednia transformacja jest wykonywana.
Liczba moli HCl = (4,8 g Cldwa) (1 mol Cldwa/ 70,9 g Cldwa) (2 mole HCl / 1 mol Cldwa)
= 0,135 mola HCl
Stosując równanie prawa gazu doskonałego:
PV = nRT
P = nRT / V
= (0,135 mola HCl) (0,08206 L atm K-1Kret-1) (310 K) / 5,25 l
= 0,65 atm
Ćwiczenie 4
0,130 g próbka związku gazowego zajmuje objętość 140 ml w temperaturze 70 ° C i pod ciśnieniem 720 torów. Jaka jest jego masa molowa?
Aby zastosować równanie gazu doskonałego, należy najpierw wprowadzić kilka zmian:
V = (140 ml) (1 l / 1000 ml)
= 0,14 l
Biorąc objętość w litrach, musimy teraz wyrazić temperaturę w kelwinach:
T = 70 ° C + 273,15 K = 243,15 K.
Na koniec musimy przeliczyć ciśnienie na jednostki atmosfery:
P = (720 torr) (1 atm / 760 tor)
= 0,947 atm
Pierwszym krokiem do rozwiązania problemu jest określenie liczby moli związku. W tym celu wykorzystuje się równanie gazu doskonałego i rozwiązujemy go n:
PV = nRT
n = PV / RT
= (0,947 atm) (0,14 l) / (0,08206 l atm K-1Kret-1) (243,15 K)
= 0,067 mola
Wystarczy obliczyć masę molową, dzieląc gramy przez uzyskane mole:
Masa cząsteczkowa = gramy związku / liczba moli.
= 0,130 g / 0,067 mola
= 19,49 g / mol
Bibliografia
- Whitten, Davis, Peck & Stanley. (2008). Chemia. (8th ed.). CENGAGE Learning.
- Ira N. Levine. (2014). Zasady fizykochemii. Szósta edycja. Mc Graw Hill.
- Glasstone. (1970). Traktat chemii fizycznej. Druga edycja. Aguilar.
- Mathews, C. K., Van Holde, K. E., and Ahern, K. G. (2002). Biochemia. 3to było Wydanie. Wydawca Pearson Addison Wesley.
- Wikipedia. (2019). Gaz doskonały. Odzyskane z: en.wikipedia.org
- Zespół redakcyjny. (2018). Prawo Boyle'a lub Prawo Boyle'a-Mariotte'a | Prawa gazów. Odzyskany z: iquimicas.com


Jeszcze bez komentarzy