
Podstawa, przygotowanie i zastosowania nośnika SIM
Plik pół SIM to półstały i zróżnicowany agar, specjalnie zaprojektowany, aby pomóc w identyfikacji niektórych bakterii, głównie z rodziny Enterobacteriaceae. Składa się z tripteiny, peptonu, siarczanu żelaza, siarczanu amonu, tiosiarczanu sodu i agaru..
Medium to pozwala na wykonanie trzech ważnych badań: produkcji siarkowodoru (H.dwaS), tworzenie indolu i ruchliwość, stąd pochodzi akronim SIM. Ze względu na swoją wielką użyteczność nie może zabraknąć go w laboratorium bakteriologicznym.

W przeciwieństwie do innych podłoży, musi być półstały, aby można było wykryć zdolność ruchu niektórych bakterii. W tym sensie test ten działa bardzo dobrze w przypadku Enterobacteriaceae, ale nie w przypadku niefermentujących pałeczek Gram-ujemnych, gdzie preferowane jest stosowanie innych metod, takich jak wisząca kropla..
Nośnik SIM pozwala na rozróżnienie pewnych specyficznych właściwości, które charakteryzują niektóre bakterie w stosunku do innych. Na przykład Escherichia coli wyróżnia się jako H.dwaS (-), indol (+) i ruchliwość (+), podczas gdy Proteus mirabilis to jest H.dwaS (+), indol (-), ruchliwość (+).
Indeks artykułów
- 1 Uzasadnienie
- 1.1 Źródło zasilania
- 1.2 Produkcja siarkowodoru
- 1.3 Tworzenie indolu
- 1.4 Ruchliwość
- 2 Przygotowanie
- 2.1 Średnia karta SIM
- 2.2 Odczynnik Kovaca
- 2.3 Odczynnik Erlicha
- 3 Zastosowania
- 3.1 Siew
- 4 Kontrola jakości
- 5 Ograniczenia
- 6 Odnośniki
Podstawa
Jest to pożywka hodowlana uważana za zróżnicowaną, ponieważ jej zastosowanie pozwala na rozróżnienie mikroorganizmów zdolnych do wytwarzania siarkowodoru od tych, które tego nie robią; Podkreśla również te, które tworzą indol z tryptofanu od tych, które go nie tworzą, a na koniec odróżnia ruchliwe bakterie od nieruchomych..
Źródło prądu
Jak każda pożywka hodowlana zawiera elementy, które dostarczają niezbędnych składników odżywczych, aby mogły się rozwijać niewymagające mikroorganizmy. Te elementy są reprezentowane przez peptony i triptein.
Rozwój mikroorganizmu w pożywce jest niezbędny, aby móc zaobserwować obecność lub brak cech, które ocenia to podłoże..
Produkcja siarkowodoru
Litera S akronimu SIM odnosi się do produkcji siarkowodoru (H.dwaS). Bakterie zdolne do tworzenia siarkowodoru pobierają siarkę z tiosiarczanu sodu.
Kiedyś H.dwaS - gaz bezbarwny - reaguje z solą żelaza obecną w medium, tworząc wyraźnie widoczny siarczek żelazawy (czarny osad). Bakterie, które nie tworzą H.dwaTak, pozostaw środek oryginalnego koloru (beż).
Obecność czarnego osadu może utrudniać interpretację ruchliwości. Jednak wiadomo, że większość Enterobacteriaceae produkujących H.dwaS to pozytywna ruchliwość, taka jak Salmonella, Proteus i Citrobacter. Ponadto czarny osad pokrywający prawie całe podłoże sugeruje pozytywną ruchliwość.
Formacja indolowa
Druga litera akronimu SIM to „I”, co oznacza tworzenie się indolu.
W tym sensie tripteina, oprócz tego, że jest źródłem składników odżywczych, spełnia inną podstawową funkcję. Ten pepton jest bogaty w aminokwas zwany tryptofanem, dlatego może wykazywać bakterie wytwarzające tryptofanazę.
Enzym ten jest odpowiedzialny za rozszczepianie aminokwasu tryptofanu, co w konsekwencji prowadzi do powstania indolu (bezbarwnej substancji), kwasu pirogronowego i amonu.
Dlatego, aby zademonstrować tę reakcję, konieczne jest dodanie substancji ujawniającej (odczynnik Ehrlicha lub odczynnik Kovaca). Każda z nich reaguje z indolem, tworząc czerwono-fuksjową substancję w kształcie pierścienia na powierzchni agaru. Jeśli pojawi się pierścień w kolorze fuksji, test indolowy jest interpretowany jako pozytywny.
Bakterie, które nie posiadają tego enzymu, nie utworzą pierścienia i jest to interpretowane jako ujemny test indolowy.
Należy zauważyć, że test indolowy powinien być interpretowany jako ostatni, ponieważ po dodaniu odczynnika podłoże staje się mętne, co utrudnia wizualizację ruchliwości..
Poruszanie się
Wreszcie litera „M” w słowie SIM oznacza ruchliwość. Aby móc ocenić ruchliwość, podłoże to jest strategicznie półstałe, ponieważ ta cecha jest niezbędna, aby móc obserwować, czy występuje ruch bakterii. Bakterie, które mają wici, to te, które dają ten pozytywny wynik.
Pozytywny wynik testu będzie widoczny, gdy zaobserwuje się zmętnienie, zarówno w początkowym inokulum, jak i wokół niego. Natomiast bakterie niemotylne rozwijają się tylko na drodze początkowego inokulum.
Przygotowanie
Średnia karta SIM
Odważyć 30 g odwodnionej pożywki i rozpuścić w litrze wody destylowanej. Mieszaninę odstawia się na 5 minut, a następnie ogrzewa do wrzenia, często mieszając, aż do całkowitego rozpuszczenia..
Rozprowadź mieszaninę w probówkach z bawełnianymi nakrętkami i autoklawuj w 121 ° C przez 15 minut. Wyjąć statyw na probówki z autoklawu i pozostawić do zestalenia w pozycji pionowej, tak aby pożywka miała kształt bloku.
W celu konserwacji jest przechowywany w lodówce do momentu użycia. Przygotowana pożywka musi mieć końcowe pH 7,3 ± 0,2.
W momencie zaszczepiania podłoże musi mieć temperaturę pokojową. Kolor środkowy to beż.
Odczynnik Kovaca
Odmierz 150 ml alkoholu amylowego, izoamylowego lub butylowego. (Użyj jednego z trzech wymienionych).
Rozpuścić 10 g p-dimetyloaminobenzaldehydu. Następnie powoli dodaj 50 ml stężonego kwasu solnego.
Gotowy do użycia odczynnik jest bezbarwny lub jasnożółty. Powinien być przechowywany w bursztynowej butelce i przechowywany w lodówce. Nie używać, jeśli przybiera ciemnobrązowy kolor; co oznacza, że jest uszkodzony. Ten odczynnik jest preferowany w przypadku Enterobacteriaceae.
Odczynnik Erlicha
Odważyć 2 g p-dimetyloaminobenzaldehydu i rozpuścić w 190 ml absolutnego alkoholu etylowego i powoli wymieszać z 40 ml stężonego kwasu solnego. Zachowaj odczynnik Kovaca w ten sam sposób. Odczynnik Ehrlicha jest używany częściej w przypadku bakterii niefermentujących i beztlenowych.
Aplikacje
Podłoże SIM jest szeroko stosowane w laboratoriach bakteriologicznych. Ma tę zaletę, że w tej samej probówce można zaobserwować trzy podstawowe cechy identyfikujące Enterobacteriaceae..
Posiany
Prawidłowym sposobem wysiewu pożywki jest użycie igły, za pomocą której pobiera się część czystej kolonii, która ma być badana, i wprowadza się ją pionowo w środek podłoża. Należy wykonać pojedynczy wypad. Nakłucie nie powinno sięgać dna tuby, dobrze jest pokryć tylko dwie trzecie głębokości.
Nie zaleca się powtarzania inokulum, ponieważ może to prowadzić do fałszywych interpretacji pozytywnej ruchliwości. Zaszczepioną pożywkę inkubuje się w warunkach tlenowych w 37 ° C przez 24 godziny..
Po tym czasie obserwuje się, czy doszło do produkcji H.dwaOdczytuje się S i ruchliwość. Wreszcie indol zostaje ujawniony, dodając 3 do 4 kropli odczynnika Ehrlicha lub Kovaca, delikatnie wymieszać i zinterpretować.
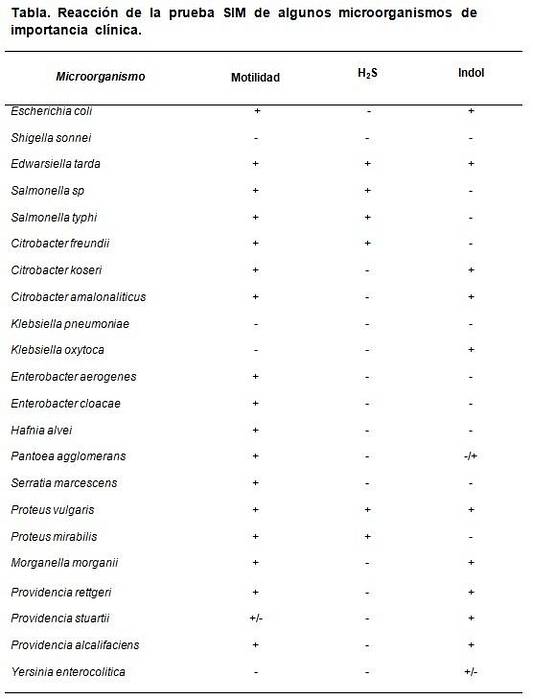
QA
Jako kontrolę sterylności jedną lub dwie probówki inkubuje się bez inokulacji w piecu w 37 ° C przez 24 godziny. Oczekuje się, że po tym czasie nie będzie wzrostu ani zmiany koloru.
Jako kontrolę jakości można wykorzystać certyfikowane znane szczepy, takie jak: Escherichia coli ATCC 25922, Enterobacter aerogenes ATCC 13048, Klebsiella pneumoniae ATCC 13883, Salmonella typhimurium ATCC 14028, Shigella sonnei ATCC 29930, Proteus vulgaris ATCC 13315.
Oczekiwane rezultaty to: Escherichia coli H.dwaS ruchliwość ujemna, indolowa i pozytywna, Enterobacter aerogenes tylko pozytywna ruchliwość, Salmonella typhimurium H.dwaS i ruchliwość dodatnia, z ujemnym indolem. Proteus vulgaris wszystkie pozytywne, podczas gdy Klebsiella pneumoniae Y Shigella sonnei wszystko negatywne.
Ograniczenia
-Niektóre odmiany Morganella morganii, Wśród innych szczepów mogą one wytwarzać brązowawy pigment w tym podłożu ze względu na produkcję melaniny, czego nie należy mylić z osadem siarczku żelazawego. U niedoświadczonych profesjonalistów taka sytuacja może generować fałszywie pozytywne wyniki w interpretacji testu H.dwaS.
-Surowe bakterie tlenowe będą rosły tylko na powierzchni probówki, co utrudni interpretację ruchliwości.
Bibliografia
- BD Laboratories. BBL SIM Medium. 2008 Dostępne na: bd.com
- Neogen Laboratories. Medium SIM. Dostępne pod adresem: foodafety
- Difco Francisco Soria Melguizo. Medium SIM. 2009. Dostępne pod adresem: http://f-soria.es
- Laboratorium Brizuela-Lab. Średnia karta SIM. Dostępne pod adresem: .brizuela-lab.com
- Britannia Laboratories. Średnia karta SIM. 2015. Dostępne pod adresem: studyres.es/doc
- Koneman E, Allen S, Janda W, Schreckenberger P, Winn W. (2004). Diagnoza mikrobiologiczna. 5th ed. Od redakcji Panamericana S.A. Argentyna.



Jeszcze bez komentarzy