
Struktura metoksyetanu, właściwości, otrzymywanie, zastosowania, zagrożenia

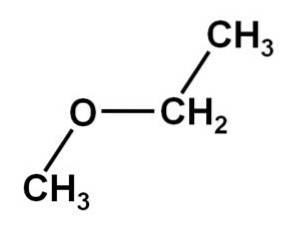
Plik metoksyetan Jest to organiczny związek z rodziny eterów lub alkoholanów. Jego wzór chemiczny to CH3OCHdwaCH3. Jest również nazywany eterem metylowo-etylowym lub eterem etylowo-metylowym. W temperaturze pokojowej jest związkiem gazowym, a jego cząsteczka ma dwie grupy metylowe -CH3, jeden bezpośrednio przyłączony do tlenu, a drugi do etylowego -CHdwaCH3.
Metoksyetan to bezbarwny gaz rozpuszczalny w wodzie, mieszalny z eterem i alkoholem etylowym. Ponieważ jest eterem, jest związkiem mało reaktywnym, jednak w wysokich temperaturach może reagować z niektórymi stężonymi kwasami..
Na ogół otrzymuje się go w tak zwanej syntezie Williamsona, która obejmuje zastosowanie alkoholanu sodu i jodku alkilu. Z kolei jego rozkład badano w różnych warunkach.
Metoksyetan jest wykorzystywany w laboratoriach badawczych do różnych celów, na przykład do badania nanomateriałów półprzewodnikowych lub do obserwacji materii międzygwiazdowej w konstelacjach i dużych obłokach molekularnych Wszechświata..
W rzeczywistości dzięki bardzo czułym teleskopom (interferometrom) został wykryty w określonych miejscach w przestrzeni międzygwiazdowej..
Indeks artykułów
- 1 Struktura
- 2 Nazewnictwo
- 3 Właściwości fizyczne
- 3.1 Stan fizyczny
- 3.2 Masa cząsteczkowa
- 3.3 Temperatura topnienia
- 3.4 Temperatura wrzenia
- 3.5 Temperatura zapłonu
- 3.6 Temperatura samozapłonu
- 3.7 Ciężar właściwy
- 3.8 Współczynnik załamania światła
- 3.9 Rozpuszczalność
- 4 Właściwości chemiczne
- 4.1 Rozkład termiczny
- 4.2 Rozkład fotouczulający
- 5 Otrzymywanie
- 6 Lokalizacja we wszechświecie
- 7 Zastosowania metoksyetanu
- 7.1 Do badań materii międzygwiazdowej
- 7.2 Wyprowadzanie przemian chemicznych w różnych dziedzinach nauki
- 7.3 Potencjalne zastosowanie w półprzewodnikach
- 8 Ryzyka
- 9 Odniesienia
Struktura
Związek metoksyetanowy ma grupę metylową -CH3 i grupę etylową -CHdwaCH3 oba połączone z tlenem.
Jak widać, w tej cząsteczce znajdują się dwie grupy metylowe, jedna przyłączona do tlenu CH3-O i druga należąca do etylowego -CHdwa-CH3.
W podstawowym lub niższym stanie energetycznym grupa metylowa -CHdwa-CH3 jest na miejscu przeł w odniesieniu do metylu związanego z tlenem, to znaczy w diametralnie przeciwnym miejscu, biorąc jako odniesienie wiązanie CHdwa-O. Dlatego jest czasami nazywany przeł-eter etylowo-metylowy.
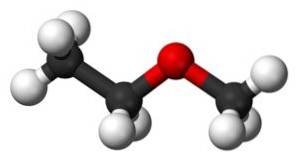
Ta cząsteczka może ulec skręceniu na wiązaniu CHdwa-Lub, który umieszcza grupę metylową w innej pozycji przestrzennej niż przeł , grupy metylowe -CH3 są bardzo blisko siebie, a skręcenie to generuje przejście energii wykrywalne przez czułe instrumenty.
Nomenklatura
- Metoksyetan.
- Eter metylowo-etylowy.
- przeł-Eter etylowo-metylowy (głównie w literaturze anglojęzycznej, tłumaczenie z języka angielskiego przeł-eter etylowo-metylowy).
Właściwości fizyczne
Stan fizyczny
Bezbarwny gaz
Waga molekularna
60,096 g / mol
Temperatura topnienia
-113,0 ºC
Temperatura wrzenia
7,4 ° C
Temperatura zapłonu
1,7 ºC (metoda zamkniętego tygla).
Temperatura samozapłonu
190 ºC
Dokładna waga
0,7251 przy 0 ºC / 0 ºC (jest mniej gęsty niż woda, ale cięższy od powietrza).
Współczynnik załamania światła
1,3420 przy 4 ºC
Rozpuszczalność
Rozpuszczalny w wodzie: 0,83 mol / l
Rozpuszczalny w acetonie. Mieszalny z alkoholem etylowym i eterem etylowym.
Właściwości chemiczne
Metoksyetan jest eterem, więc jest stosunkowo niereaktywny. Wiązanie węgiel-tlen-węgiel C-O-C jest bardzo stabilne w stosunku do zasad, środków utleniających i redukujących. Jest rozkładany tylko przez kwasy, ale zachodzi tylko w energicznych warunkach, to znaczy przy stężonych kwasach i wysokich temperaturach..
Jednak ma tendencję do utleniania się w obecności powietrza, tworząc niestabilne nadtlenki. Jeśli pojemniki go zawierające zostaną wystawione na działanie ciepła lub ognia, pojemniki eksplodują gwałtownie.
Rozkład ciepła
Gdy metoksyetan jest podgrzewany w temperaturze od 450 do 550 ° C, rozkłada się na aldehyd octowy, etan i metan. Ta reakcja jest katalizowana przez obecność jodku etylu, który jest na ogół obecny w laboratoryjnych próbkach metoksyetanu, ponieważ jest używany do jego otrzymania..
Rozkład fotouczulający
Metoksyetan napromieniowany lampą rtęciową (długość fali 2537 Å) rozkłada się tworząc szeroką gamę związków, w tym: wodór, 2,3-dimetoksybutan, 1-etoksy-2-metoksypropan i eter metylowo-winylowy..
Końcowe produkty zależą od czasu naświetlania próbki, ponieważ w miarę trwania napromieniania te, które są początkowo utworzone, dają początek nowym związkom..
Przedłużając czas naświetlania, można również wytworzyć propan, metanol, etanol, aceton, 2-butanon, tlenek węgla, eter etylowo-n-propylowy i eter metylowo-sec-butylowy..
Otrzymywanie
Będąc eterem niesymetrycznym, metoksyetan można otrzymać w reakcji między metanolanem sodu CH3ONa i jodek etylu CH3CHdwaI. Ten typ reakcji nazywa się syntezą Williamsona.
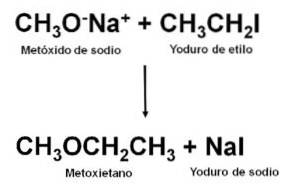
Po przeprowadzeniu reakcji mieszaninę destyluje się, otrzymując eter.
Można go również otrzymać stosując etanolan sodu CH3CHdwaONa i siarczan metylu (CH3)dwapołudniowy zachód4.
Lokalizacja we wszechświecie
Plik przeł-Eter etylowo-metylowy został wykryty w ośrodku międzygwiazdowym w takich regionach jak konstelacja Oriona KL oraz w gigantycznym obłoku molekularnym W51e2.

Wykrywanie tego związku w przestrzeni międzygwiazdowej wraz z analizą jego obfitości pomaga w budowaniu modeli chemii międzygwiazdowej..
Zastosowania metoksyetanu
Metoksyetan lub eter metylowo-etylowy jest używany głównie w eksperymentach laboratoryjnych do badań naukowych.
Do badań materii międzygwiazdowej
Będąc organiczną cząsteczką z wewnętrznymi rotacjami, metoksyetan jest związkiem chemicznym, który może być interesujący w badaniach materii międzygwiazdowej..
Wewnętrzne rotacje jego grup metylowych powodują przejścia energii w obszarze mikrofal.
Dlatego mogą być wykrywane przez bardzo czułe teleskopy, takie jak Atacama Large Millimeter / submillimeter Ensemble lub ALMA. Atacama Large Millimeter / submilimeter Array).

Dzięki swojej rotacji wewnętrznej i dużym obserwatoriom kosmicznym przeł-Eter metylowo-etylowy został znaleziony w konstelacji Oriona oraz w gigantycznym obłoku molekularnym W51e2.
Wyprowadzanie przemian chemicznych w różnych dziedzinach nauki
Niektórzy badacze zaobserwowali tworzenie metoksyetanu lub eteru metylowo-etylowego, gdy mieszanina etylenu CH jest napromieniowana elektronami.dwa= CHdwa i metanol CH3O.
Mechanizm reakcji polega na tworzeniu rodnika CH3O •, który atakuje bogate w elektrony podwójne wiązanie CHdwa= CHdwa. Powstały addukt CH3-O-CHdwa-CHdwa• wychwytuje wodór z CH3OH i tworzy eter metylowo-etylowy CH3-O-CHdwa-CH3.
Badanie tego typu reakcji wywołanych napromieniowaniem elektronów jest przydatne w dziedzinie biochemii, ponieważ stwierdzono, że mogą one powodować uszkodzenie DNA, lub w dziedzinie chemii metaloorganicznej, ponieważ sprzyja tworzeniu się nanostruktur..
Ponadto wiadomo, że duże ilości elektronów wtórnych są wytwarzane, gdy promieniowanie elektromagnetyczne lub cząsteczkowe oddziałuje ze skondensowaną materią w przestrzeni..
Dlatego szacuje się, że te elektrony mogą inicjować przemiany chemiczne w materii pyłu międzygwiazdowego. Stąd znaczenie badania eteru metylowo-etylowego w tych reakcjach..
Potencjalne zastosowanie w półprzewodnikach
Za pomocą obliczeniowych metod obliczeniowych niektórzy naukowcy odkryli, że metoksyetan lub eter metylowo-etylowy może być adsorbowany przez grafen domieszkowany galem (Ga) (zauważ, że adsorpcja różni się od absorpcji).
Grafen to nanomateriał składający się z atomów węgla ułożonych w sześciokątny wzór..

Adsorpcja metoksyetanu na domieszkowanym grafenie zachodzi w wyniku interakcji między tlenem w eterze a atomem galu na powierzchni nanomateriału. Z powodu tej adsorpcji następuje przeniesienie ładunku netto z eteru do galu..
Grafen domieszkowany galem po adsorpcji eteru metylowo-etylowego i dzięki temu przenoszeniu ładunku wykazuje właściwości półprzewodnikowe typu p.
Ryzyka
Metoksyetan jest wysoce łatwopalny.
W kontakcie z powietrzem ma tendencję do tworzenia niestabilnych i wybuchowych nadtlenków.
Bibliografia
- NAS. National Library of Medicine. (2019). Eter etylowo-metylowy. Odzyskany z: pubchem.ncbi.nlm.nih.gov.
- Irvine W.M. (2019) Eter etylowo-metylowy (C.dwaH.5OCH3). W: Gargaud M. i in. (red.). Encyklopedia astrobiologii. Springer, Berlin, Heidelberg. Odzyskany z link.springer.com.
- Po trzecie, B. i in. (2015). Poszukiwanie eteru trans etylowo-metylowego w Orion KL. Astronomia i astrofizyka. 582, L1 (2015). Odzyskany z ncbi.nlm.nih.gov.
- Filseth, S.V. (1969). Mercury 6 (3P.1) Światłoczuły rozkład eteru metylowo-etylowego. The Journal of Physical Chemistry. Tom 73, numer 4, kwiecień 1969, 793-797. Odzyskany z pubs.acs.org.
- Casanova, J.Jr. (1963). Przygotowanie i manipulowanie przez studenta eterem etylowo-gazowym. Journal of Chemical Education. Tom 40, numer 1, styczeń 1963. Odzyskany z pubs.acs.org.
- Ure, W. i Young, J.T. (1933a). O mechanizmie reakcji gazowych. I. Rozkład termiczny eteru metylowo-etylowego. The Journal of Physical Chemistry, tom XXXVII, nr 9: 1169-1182. Odzyskany z pubs.acs.org.
- Ure, W. i Young, J.T. (1933b). O mechanizmie reakcji gazowych. II. Homogeniczna kataliza rozkładu eteru metylowo-etylowego. The Journal of Physical Chemistry, 37, 9, 1183–1190. Odzyskany z pubs.acs.org.
- Shokuhi Rad, A. i in. (2017). Badanie DFT dotyczące adsorpcji eterów dietylowych, etylometylowych i dimetylowych na powierzchni grafenu domieszkowanego galem. Applied Surface Science. Tom 401, 15 kwietnia 2017, strony 156-161. Odzyskany z sciencedirect.com.
- Schmidt, F. i in. (2019). Indukowane elektronami tworzenie eteru etylowo-metylowego w skondensowanych mieszaninach metanolu i etylenu. J. Phys. Chem. A 2019, 123, 1, 37–47. Odzyskany z pubs.acs.org.

Jeszcze bez komentarzy