
Mieszanina racemiczna chiralności, przykłady

ZA mieszanina racemiczna lub racemat to taki, który składa się z dwóch enancjomerów w równych częściach, a zatem jest optycznie nieaktywny. Ta aktywność optyczna odnosi się do zdolności jej roztworów do obracania, zgodnie z ruchem wskazówek zegara lub przeciwnie do ruchu wskazówek zegara, wiązki spolaryzowanego światła, która przepływa przez nie w jednym kierunku..
Enancjomer ma zdolność obracania światła spolaryzowanego, powiedzmy, w lewo (lewoskrętne), więc jego czysty roztwór będzie optycznie aktywny. Jeśli jednak enancjomer, który skręca światło w prawo (prawoskrętne), zacznie być do niego dodawany, jego aktywność optyczna będzie się zmniejszać, aż zostanie dezaktywowana..

Kiedy tak się dzieje, mówi się, że są równe ilości lewych i prawych enancjomerów; Jeśli molekuła obraca spolaryzowane światło w lewo, jego efekt zostanie natychmiast anulowany, gdy „potknie się” z inną cząsteczką, która obróci je w prawo. I tak dalej. Dlatego będziemy mieć mieszaninę racemiczną.
Pierwszej obserwacji enancjomeru dokonał francuski chemik Louis Pasteur w 1848 r., Który badał mieszaninę enancjomerycznych kryształów kwasu winowego (zwanego wówczas kwasem racemicznym). Ponieważ ten kwas pochodził z winogron używanych do produkcji win, ta mieszanka została zastosowana w sposób ogólny dla wszystkich cząsteczek.
Indeks artykułów
- 1 Buty i chiralność
- 2 Przykłady
- 2.1 Kwas winowy
- 2.2 Chinina
- 2.3 Talidomid
- 2,4 1,2-epoksypropan
- 2,5 1-fenyloetyloamina
- 2.6 Komentarz końcowy
- 3 Odnośniki
Buty i chiralność
Po pierwsze, aby powstała mieszanina racemiczna, muszą istnieć dwa enancjomery (zwykle), co oznacza, że obie cząsteczki są chiralne i ich lustrzane odbicia nie mogą się na siebie nakładać. Para butów doskonale to ilustruje: bez względu na to, jak bardzo będziesz starać się nałożyć lewy but na prawy, nigdy nie będą pasować..
Można powiedzieć, że prawy but odbija spolaryzowane światło w lewo; podczas gdy lewy but robi to po prawej stronie. W hipotetycznym rozwiązaniu, w którym buty są cząsteczkami, jeśli są tylko proste, chiralne buty, będzie to optycznie aktywne. To samo stanie się, jeśli w roztworze zostaną tylko buty.
Jeśli jednak jest tysiąc lewych butów zmieszanych z tysiącem prawych butów, mamy do czynienia z mieszanką racemiczną, która jest również optycznie nieaktywna, ponieważ odchylenia spowodowane przez światło w środku znoszą się wzajemnie..
Gdyby zamiast butów byłyby kulkami, przedmiotami achiralnymi, niemożliwe byłoby istnienie ich mieszanin racemicznych, ponieważ nie byłyby one nawet zdolne do istnienia jako pary enancjomerów.
Przykłady
Kwas winowy
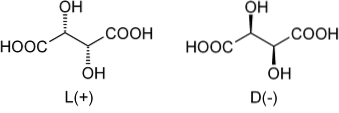
Wracając do kwasu winowego, jako pierwsza znana była jego mieszanina racemiczna. Na górnym obrazie pokazano jego dwa enancjomery, z których każdy jest zdolny do tworzenia kryształów o morfologicznej „lewej” lub „prawej” powierzchni. Pasteurowi, dzięki pomocy mikroskopu i rygorystycznym wysiłkom, udało się oddzielić od siebie te enancjomeryczne kryształy..
Kryształy enancjomerów L (+) i D (-) oddzielnie wykazują aktywność optyczną odchylając światło spolaryzowane odpowiednio w prawo lub w lewo. Jeśli oba kryształy w równych proporcjach molowych rozpuszczą się w wodzie, otrzymana zostanie optycznie nieaktywna mieszanina racemiczna..
Należy zauważyć, że oba enancjomery mają dwa chiralne atomy węgla (z czterema różnymi podstawnikami). W L (+) OH znajdują się za płaszczyzną utworzoną przez szkielet węglowy i grupy COOH; podczas gdy w D (-) te OH znajdują się powyżej wspomnianej płaszczyzny.
Ci, którzy syntetyzują kwas winowy, otrzymają mieszaninę racemiczną. Aby oddzielić enancjomer L (+) od D (-), konieczne jest rozdzielenie chiralne, w którym tę mieszaninę poddaje się reakcji z chiralną zasadą w celu wytworzenia soli diastereoizomerycznych, które można później rozdzielić przez krystalizację frakcyjną..
Chinina

W powyższym przykładzie w odniesieniu do racemicznej mieszaniny kwasu winowego jest zwykle zapisywane jako kwas (±) -winowy. Zatem w przypadku chininy (górny obraz) będzie to (±) -kinina.
Izomeria chininy jest złożona: ma cztery chiralne atomy węgla, z których powstaje szesnaście diastereoizomerów. Co ciekawe, dwa z jego enancjomerów (jeden z OH nad płaszczyzną, a drugi poniżej) są w rzeczywistości diastereoizomerami, ponieważ różnią się konfiguracją innych chiralnych atomów węgla (tych z bicyklonu z atomem N).
Jednak trudno jest określić, który ze stereoizomerów chininy będzie odchylał spolaryzowane światło w prawo lub w lewo..
Talidomid
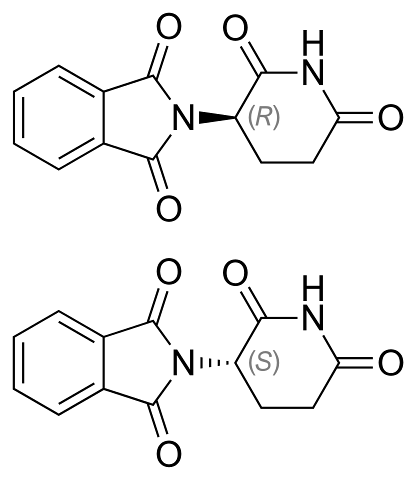
Powyżej przedstawiono enancjomery talidomidu. Ma tylko jeden chiralny węgiel: ten, który jest połączony z azotem łączącym oba pierścienie (jeden z ftalimidu, a drugi z gluteramidem).
W enancjomerze R (o właściwościach uspokajających) pierścień ftalimidu (ten po lewej) jest zorientowany powyżej płaszczyzny; natomiast w enancjomerze S (o właściwościach mutagennych) poniżej.
Oczu nie wiadomo, który procent odbija światło w lewo czy w prawo. Wiadomo, że mieszanina 1: 1 lub 50% obu enancjomerów tworzy mieszaninę racemiczną (±) -talidomid.
Jeśli chcesz sprzedawać talidomid tylko jako nasenny środek uspokajający, obowiązkowe jest poddanie jego racemicznej mieszaniny wspomnianemu już rozdziałowi chiralnemu w taki sposób, aby uzyskać czysty enancjomer R..
1,2-epoksypropan
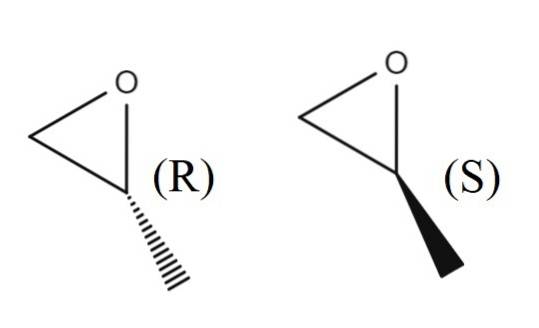
Na górnym obrazku masz parę enancjomerów 1,2-epoksypropanu. Enancjomer R odchyla światło spolaryzowane w prawo, podczas gdy enancjomer S odchyla je w lewo; czyli pierwszy to (R) - (+) - 1,2-epoksypropan, a drugi to (S) - (-) - 1,2-epoksypropan.
Racemiczna mieszanina tych dwóch, ponownie, w stosunku 1: 1 lub 50%, staje się (±) -1,2-epoksypropanem.
1-fenyloetyloamina
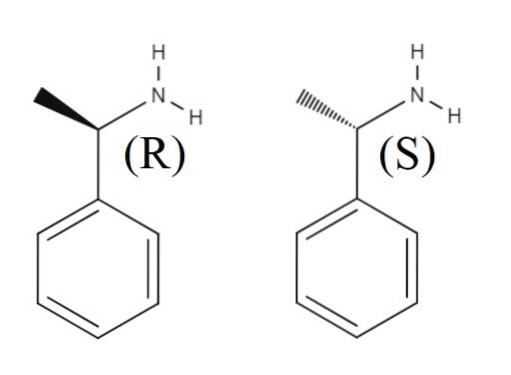
Powyżej znajduje się inna mieszanina racemiczna utworzona przez dwa enancjomery 1-fenyloetyloaminy. Enancjomer R to (R) - (+) - 1-fenyloetyloamina, a enancjomer S to (S) - (-) - 1-fenyloetyloamina; jeden ma grupę metylową CH3, wskazujący poza płaszczyznę pierścienia aromatycznego, a drugi skierowany poniżej.
Zauważ, że gdy konfiguracja to R, czasami pokrywa się to z faktem, że enancjomer obraca spolaryzowane światło w prawo; jednak nie zawsze ma to zastosowanie i nie może być traktowane jako ogólna zasada.
Komentarz końcowy
Ważniejsze od istnienia lub braku mieszanin racemicznych jest ich rozdzielczość chiralna. Dotyczy to zwłaszcza związków o działaniu farmakologicznym, które zależą od wspomnianej stereoizomerii; to znaczy, że jeden enancjomer może być korzystny dla pacjenta, podczas gdy drugi może na niego wpływać.
Dlatego te chiralne rozdzielczości są używane do rozdzielania mieszanin racemicznych na ich składniki, a tym samym do sprzedawania ich jako czyste leki wolne od szkodliwych zanieczyszczeń..
Bibliografia
- Morrison, R. T. i Boyd, R, N. (1987). Chemia organiczna. Wydanie 5. Od redakcji Addison-Wesley Interamericana.
- Carey F. (2008). Chemia organiczna. (Wydanie szóste). Mc Graw Hill.
- Graham Solomons T.W., Craig B. Fryhle. (2011). Chemia organiczna. Aminy. (Wydanie 10.). Wiley plus.
- Steven A. Hardinger. (2017). Ilustrowany słownik chemii organicznej: mieszanina racemiczna. Katedra Chemii i Biochemii UCLA. Odzyskany z: chem.ucla.edu
- Nancy Devino. (2019). Mieszanina racemiczna: definicja i przykład. Nauka. Odzyskany z: study.com
- James Ashenhurst. (2019). Stereochemia i chiralność: co to jest mieszanina rasemiczna? Odzyskane z: masterorganicchemistry.com
- John C. Leffingwell. (2003). Chiralność i bioaktywność I.: Farmakologia. [PDF]. Odzyskany z: leffingwell.com



Jeszcze bez komentarzy