
Struktura mioglobiny, funkcja, wartości prawidłowe
Plik mioglobina Jest to globularne białko wewnątrzkomórkowe występujące w cytozolu komórek mięśni szkieletowych i mięśnia sercowego. Jego podstawową funkcją jest tworzenie rezerwy tlenu i wspomaganie wewnątrzkomórkowego transportu tlenu..
John Kendrew i Max Perutz otrzymali Nagrodę Nobla w dziedzinie chemii w 1962 roku za badania nad białkami kulistymi. Autorzy ci wyjaśnili trójwymiarową strukturę, odpowiednio, mioglobiny i hemoglobiny. Historycznie rzecz biorąc, mioglobina była jednym z pierwszych białek, na podstawie których określono trójwymiarową strukturę..
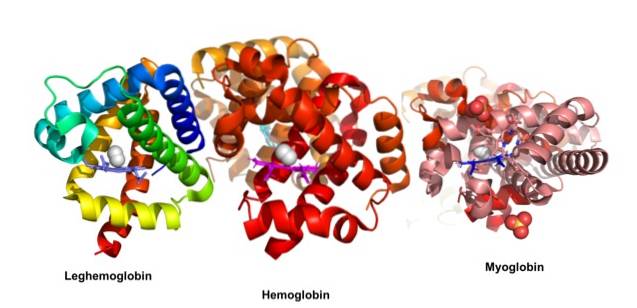
Białka globularne to zwarte cząsteczki o kulistym kształcie; są rozpuszczalne w cytozolu lub w lipidowej części błon komórkowych. Odpowiadają za główne działania biologiczne, w przeciwieństwie do białek włóknistych, których główne funkcje mają charakter strukturalny.
Mioglobina nadaje świeżemu mięsu czerwony kolor. Dzieje się tak, gdy mioglobina jest utleniona jako oksymioglobina, a żelazo, które ją tworzy, ma postać żelaza żelazawego: Mb-Fe2 + O2.
Gdy mięso jest wystawione na działanie środowiska, niestabilne żelazo żelazne utlenia się i staje się żelazem iw tych warunkach kolor zmienia się na brązowy z powodu tworzenia się metamioglobiny (Mb-Fe3 + + O2 ● -).
Zwykle poziomy mioglobiny we krwi są bardzo małe, rzędu mikrogramów na litr (μg / l). Poziomy te zwiększają się, gdy dochodzi do zniszczenia mięśni, jak w przypadku rabdomiolizy mięśni szkieletowych lub zawału serca z niszczeniem tkanek oraz w niektórych miopatiach..
Jego obecność w moczu obserwuje się w określonych stanach, w których uszkodzenie tkanek jest bardzo ważne. Jego wczesna wartość diagnostyczna w przypadku zawału serca jest dyskusyjna.
Indeks artykułów
- 1 Struktura mioglobiny
- 2 Funkcja
- 2.1 Rodzaje włókien mięśniowych i mioglobiny
- 3 Wartości normalne
- 4 Odnośniki
Struktura mioglobiny
Mioglobina ma masę cząsteczkową prawie 18 kDa, w tym grupę hemową. Składa się z czterech helikalnych segmentów połączonych „ostrymi zwojami”. Te helisy mioglobiny są ciasno upakowane i zachowują swoją integralność strukturalną nawet po usunięciu grupy hemu..
Struktura białek globularnych, jak również wszystkich białek komórkowych, jest hierarchiczna, więc struktura mioglobiny jest również hierarchiczna. Pierwszy poziom to struktura pierwotna utworzona przez liniową sekwencję aminokwasów, a mioglobina składa się z łańcucha 153 aminokwasów..
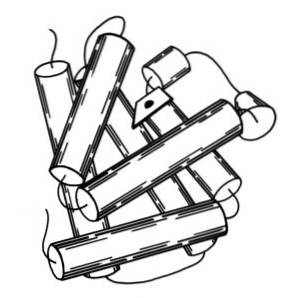
Drugorzędowa struktura mioglobiny składa się z konformacji helis alfa. Mioglobina zawiera 8 helis alfa utworzonych przez powtarzające się fragmenty polipeptydu, które są połączone krótkimi segmentami w układzie nieokresowym..
Trzeciorzędowa struktura składa się z trójwymiarowej konformacji o aktywności biologicznej. Najważniejszymi cechami tej konstrukcji są fałdy. Struktura czwartorzędowa odnosi się do połączenia dwóch lub więcej łańcuchów polipeptydowych oddzielonych i połączonych niekowalencyjnymi wiązaniami lub oddziaływaniami..
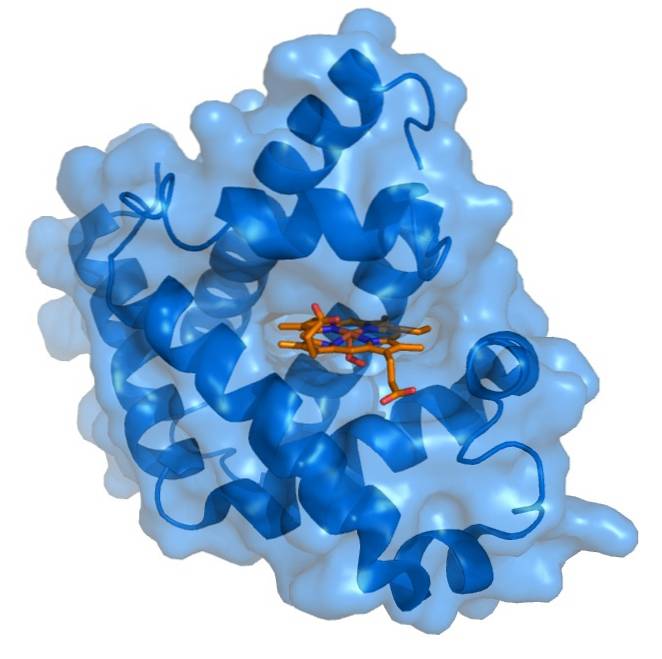
Mioglobina ma bardzo zwartą strukturę, z resztami hydrofobowymi skierowanymi do wewnątrz i resztami hydrofilowymi lub polarnymi skierowanymi na zewnątrz. Wewnętrzne reszty niepolarne składają się z leucyny, waliny, metioniny i fenyloalaniny. Jedynymi wewnętrznymi resztami polarnymi są dwie histydyny, które pełnią funkcje w centrum aktywnym..
Grupa protetyczna hemu znajduje się w szczelinie apolarnej wewnętrznej części łańcucha polipeptydowego mioglobiny. Ta grupa zawiera żelazo w postaci żelaza żelazawego, które wiąże się z tlenem, tworząc oksymioglobinę..
Funkcjonować
Zadaniem mioglobiny jest wiązanie tlenu z grupą hemową jej struktury i tworzenie rezerwy tlenu dla funkcji mięśni. Ponieważ tlen jest uwięziony w strukturze mioglobiny w cytoplazmie komórki mięśniowej, jego ciśnienie wewnątrzkomórkowe, określane przez wolny tlen, pozostaje niskie..
Niskie ciśnienie wewnątrzkomórkowe tlenu utrzymuje gradient umożliwiający przenikanie tlenu do komórki. To sprzyja przechodzeniu tlenu z krwiobiegu do komórki mięśniowej. Kiedy mioglobina jest nasycona, wewnątrzkomórkowy tlen wzrasta, co stopniowo zmniejsza gradient, a tym samym zmniejsza transfer.
Krzywa wiązania tlenu z mioglobiną jest hiperboliczna. W początkowych częściach krzywej niewielkie zmiany ciśnienia parcjalnego tlenu powodują duże zmiany w nasyceniu mioglobiny tlenem..
Następnie, wraz ze wzrostem ciśnienia parcjalnego tlenu, nasycenie nadal rośnie, ale wolniej, to znaczy do zwiększenia nasycenia mioglobiny potrzebny jest znacznie większy wzrost ciśnienia parcjalnego tlenu, a krzywa jest stopniowo spłaszczana.
Istnieje zmienna, która mierzy powinowactwo krzywej zwanej P50, reprezentuje ciśnienie parcjalne tlenu niezbędne do nasycenia mioglobiny zawartej w roztworze o 50%. Tak więc, jeśli wzrasta P50, mówi się, że mioglobina ma mniejsze powinowactwo, a jeśli P50 spada, mówi się, że mioglobina ma większe powinowactwo do tlenu..
Podczas badania krzywych wiązania tlenu dla mioglobiny i hemoglobiny obserwuje się, że dla każdego badanego ciśnienia parcjalnego tlenu mioglobina staje się bardziej nasycona niż hemoglobina, co wskazuje, że mioglobina ma większe powinowactwo do tlenu niż hemoglobina.
Rodzaje włókien mięśniowych i mioglobiny
Mięśnie szkieletowe mają w swoim składzie różne rodzaje włókien mięśniowych, niektóre nazywane są wolnokurczliwymi, a inne szybkokurczliwymi. Szybkokurczliwe włókna są strukturalnie i metabolicznie przystosowane do szybkiego i energicznego skurczu oraz beztlenowego.
Wolnokurczliwe włókna są przystosowane do wolniejszych, ale dłuższych skurczów typowych dla ćwiczeń aerobowych oporowych. Jedną z różnic strukturalnych tych włókien jest stężenie mioglobiny, co daje im nazwę włókien białych i czerwonych..
Włókna czerwone mają wysoką zawartość mioglobiny, która nadaje im czerwony kolor, ale także pozwala na utrzymanie dużej ilości niezbędnego do ich funkcjonowania tlenu..
Wartości normalne
Normalne wartości krwi dla mężczyzn wynoszą od 19 do 92 µg / l, a dla kobiet od 12 do 76 µg / l, jednak istnieją różnice w wartościach w różnych laboratoriach..
Wartości te zwiększają się, gdy dochodzi do zniszczenia mięśni, jak ma to miejsce w przypadku rabdomiolizy mięśni szkieletowych, rozległych oparzeń, wstrząsów elektrycznych lub rozległej martwicy mięśni spowodowanej zamknięciem tętnic, zawału mięśnia sercowego i niektórych miopatii..
W tych warunkach mioglobina pojawia się w moczu i nadaje mu charakterystyczny kolor..
Bibliografia
- Fauci, A. S., Kasper, D. L., Hauser, S. L., Jameson, J. L. i Loscalzo, J. (2012). Zasady medycyny wewnętrznej Harrisona. D. L. Longo (red.). Nowy Jork: Mcgraw-hill
- Ganong WF: Centralna regulacja funkcji trzewnych, w Przegląd fizjologii medycznej, 25th ed. Nowy Jork, McGraw-Hill Education, 2016.
- Guyton AC, Hall JE: The Body Fluid Compartments: Extracellular and intracellular fluid; Obrzęk, w Podręcznik fizjologii medycznej, 13 edycja, AC Guyton, JE Hall (red.). Filadelfia, Elsevier Inc., 2016.
- McCance, K. L. i Huether, S. E. (2018). Patofizjologia-Ebook: biologiczne podłoże chorób u dorosłych i dzieci. Elsevier Health Sciences.
- Murray, R. K., Granner, D. K., Mayes, P. A. i Rodwell, V. W. (2014). Ilustrowana biochemia Harpera. Mcgraw-hill.



Jeszcze bez komentarzy