
Charakterystyka modelu atomowego Thomsona, postulaty, cząstki subatomowe

Plik Model atomowy Thomsona Został stworzony przez znanego angielskiego fizyka J. J. Thomsona, który odkrył elektron. Za to odkrycie i swoją pracę nad przewodnictwem elektrycznym w gazach otrzymał w 1906 roku Nagrodę Nobla w dziedzinie fizyki.
Z jego pracy z promieniami katodowymi stało się jasne, że atom nie był niepodzielną jednostką, jak postulował Dalton w poprzednim modelu, ale zawierał dobrze określoną strukturę wewnętrzną..
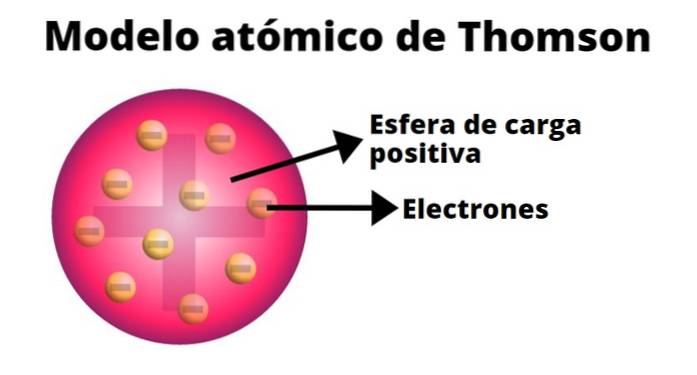
Thomson stworzył model atomu na podstawie wyników swoich eksperymentów z promieniami katodowymi. Stwierdził w nim, że elektrycznie obojętny atom składa się z dodatnich i ujemnych ładunków równej wielkości..
Indeks artykułów
- 1 Jak nazwano model atomowy Thomsona i dlaczego?
- 2 Charakterystyka i postulaty modelu Thomsona
- 2.1 Promienie katodowe
- 3 Cząstki subatomowe z modelu atomowego Thomsona
- 3.1 Rurka Crookesa
- 3.2 Naładowane cząstki w jednolitych polach elektrycznych i magnetycznych
- 4 Eksperyment Thomsona
- 4.1 Zależność ładunku od masy elektronu
- 5 Różnice modeli Thomsona i Daltona
- 6 Modelowe awarie i ograniczenia
- 7 Ciekawe artykuły
- 8 Odniesienia
Jak nazwano atomowy model Thomsona i dlaczego?
Według Thomsona ładunek dodatni był rozłożony w całym atomie, a ładunki ujemne były w nim osadzone jak rodzynki w budyniu. Z tego porównania wywodzi się termin „budyń rodzynkowy”, ponieważ model ten był nieformalnie znany..

Chociaż pomysł Thomsona wygląda dziś dość prymitywnie, w swoim czasie stanowił nowatorski wkład. Podczas krótkiego życia modelu (od 1904 do 1910 roku) miał on poparcie wielu naukowców, choć wielu innych uważało go za herezję.
W końcu w 1910 roku pojawiły się nowe dowody na temat struktury atomu, a model Thomsona szybko upadł na bok. Stało się to, gdy tylko Rutherford opublikował wyniki swoich eksperymentów rozpraszania, które ujawniły istnienie jądra atomowego..
Jednak model Thomsona był pierwszym, który postulował istnienie cząstek subatomowych, a jego wyniki były owocem drobnych i rygorystycznych eksperymentów. W ten sposób ustanowił precedens dla wszystkich późniejszych odkryć..
Charakterystyka i postulaty modelu Thomsona
Thomson doszedł do swojego modelu atomowego na podstawie kilku obserwacji. Po pierwsze, promieniowanie rentgenowskie nowo odkryte przez Roentgena było zdolne do jonizacji cząsteczek powietrza. Do tej pory jedynym sposobem na jonizację była chemiczna separacja jonów w roztworze..
Ale angielskiemu fizykowi udało się z powodzeniem zjonizować nawet gazy jednoatomowe, takie jak hel, za pomocą promieni rentgenowskich. Doprowadziło go to do przekonania, że ładunek wewnątrz atomu można oddzielić, a zatem nie jest on niepodzielny. Zauważył również, że promienie katodowe mogą być odchylane przez pola elektryczne i magnetyczne.

Dlatego Thomson opracował model, który poprawnie wyjaśnił fakt, że atom jest elektrycznie obojętny, a promienie katodowe składają się z ujemnie naładowanych cząstek..
Korzystając z dowodów eksperymentalnych, Thomson scharakteryzował atom w następujący sposób:
-Atom jest elektrycznie obojętną stałą kulą o promieniu około 10-10 m.
-Ładunek dodatni jest mniej więcej równomiernie rozłożony na kuli.
-Atom zawiera ujemnie naładowane „cząsteczki”, które zapewniają jego neutralność..
-Te cząsteczki są takie same dla każdej materii.
-Kiedy atom jest w równowadze, to jest n ciałka ułożone regularnie w pierścienie w sferze ładunku dodatniego.
-Masa atomu jest równomiernie rozłożona.
Promienie katodowe

Thomson przeprowadził swoje eksperymenty przy użyciu promieni katodowych, odkrytych w 1859 r. Promienie katodowe to wiązki ujemnie naładowanych cząstek. Do ich produkcji wykorzystuje się szklane rurki próżniowe, w których umieszczane są dwie elektrody tzw katoda Y anoda.
Następnie przepuszczany jest prąd elektryczny, który podgrzewa katodę, która w ten sposób emituje niewidzialne promieniowanie kierowane bezpośrednio na przeciwległą elektrodę..
Aby wykryć promieniowanie, które jest niczym innym jak promieniami katodowymi, ściana rury za anodą jest pokryta materiałem fluorescencyjnym. Kiedy promieniowanie tam dociera, ścianka rury emituje intensywną jasność.
Jeśli ciało stałe przeszkadza promieniom katodowym, rzuca cień na ścianę rury. Oznacza to, że promienie poruszają się po linii prostej, a także, że można je łatwo zablokować..
Charakter promieni katodowych był szeroko dyskutowany, ponieważ ich natura była nieznana. Niektórzy uważali, że są to fale elektromagnetyczne, podczas gdy inni twierdzili, że są to cząstki..
Subatomowe cząsteczki Model atomowy Thomsona
Jak powiedzieliśmy, model atomowy Thomsona jako pierwszy postuluje istnienie cząstek subatomowych. Ciałka Thomsona to nic innego jak elektrony, podstawowe ujemnie naładowane cząstki atomu..
Obecnie wiemy, że pozostałe dwie podstawowe cząstki to dodatnio naładowany proton i nienaładowany neutron..
Jednak nie zostały one odkryte w czasie, gdy Thomson opracowywał swój model. W atomie rozłożony był ładunek dodatni, nie uwzględniał on żadnej cząstki niosącej ten ładunek iw tej chwili nie było żadnych dowodów na jego istnienie.
Z tego powodu jego model istniał przelotnie, ponieważ w ciągu kilku lat eksperymenty rozpraszania Rutherforda utorowały drogę do odkrycia protonu. A jeśli chodzi o neutron, sam Rutherford zaproponował jego istnienie na kilka lat przed jego ostatecznym odkryciem..
Rurka Crookesa
Sir William Crookes (1832-1919) zaprojektował lampę noszącą jego imię około 1870 roku, z zamiarem dokładnego zbadania natury promieni katodowych. Dodał pola elektryczne i pola magnetyczne i zaobserwował, że promienie są przez nie odchylane.
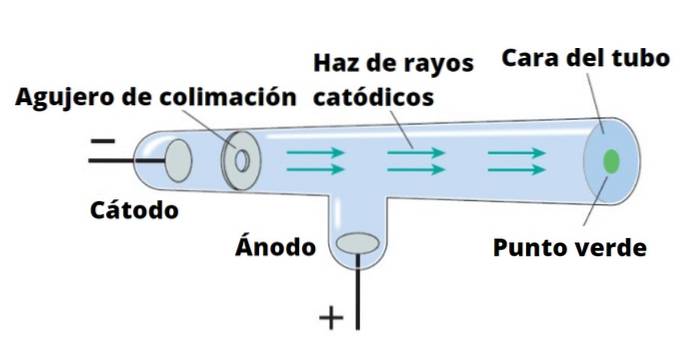
Tak więc Crookes i inni badacze, w tym Thomson, stwierdzili, że:
- Wewnątrz lampy elektronopromieniowej wytworzył się prąd elektryczny
- Promienie zostały odchylone przez obecność pól magnetycznych w taki sam sposób, jak ujemnie naładowane cząstki..
- Każdy metal użyty do wykonania katody równie dobrze służył do wytwarzania promieni katodowych, a ich zachowanie było niezależne od materiału..
Obserwacje te podsyciły dyskusję na temat pochodzenia promieni katodowych. Ci, którzy utrzymywali, że są falami, opierali się na fakcie, że promienie katodowe mogą podróżować w linii prostej. Ponadto hipoteza ta bardzo dobrze wyjaśniała cień, który wstawiony stały obiekt rzucał na ścianę rury, a w pewnych okolicznościach było wiadomo, że fale mogą powodować fluorescencję.
Ale z drugiej strony nie było wiadomo, w jaki sposób pola magnetyczne mogą odchylać promienie katodowe. Można to wyjaśnić tylko wtedy, gdyby wspomniane promienie były traktowane jako cząstki, hipoteza, którą podzielał Thomson..
Naładowane cząstki w jednolitych polach elektrycznych i magnetycznych
Naładowana cząstka z ładunkiem q doświadcza siły Fe w środku jednolitego pola elektrycznego E o wielkości:
Fe = qE
Kiedy naładowana cząstka prostopadle przechodzi przez jednolite pole elektryczne, takie jak wytwarzane między dwiema płytami o przeciwnych ładunkach, doświadcza ugięcia, a w konsekwencji przyspieszenia:
qE = ma
a = qE / m
Z drugiej strony, jeśli naładowana cząstka porusza się z prędkością v, w środku jednolitego pola magnetycznego o wielkości B, siła magnetyczna Fm, której doświadcza, ma następującą intensywność:
Fm = qvB
Dopóki wektory prędkości i pola magnetycznego są prostopadłe. Kiedy naładowana cząstka uderza prostopadle w jednorodne pole magnetyczne, również podlega ugięciu, a jej ruch jest równomierny kołowy.
Przyspieszenie dośrodkowe przydo w tym przypadku jest to:
qvB = mado
Z kolei przyspieszenie dośrodkowe jest związane z prędkością cząstki v i promieniem R toru kołowego:
dodo = wdwa/ R
W związku z tym:
qvB = mvdwa/ R
Promień ścieżki kołowej można obliczyć w następujący sposób:
R = mv / qB
Te równania zostaną później wykorzystane do odtworzenia sposobu, w jaki Thomson wyprowadził zależność ładunku od masy elektronu..
Eksperyment Thomsona
Thomson przepuścił wiązkę promieni katodowych, wiązkę elektronów, choć jeszcze o tym nie wiedział, przez jednorodne pola elektryczne. Pola te powstają między dwiema naładowanymi płytkami przewodzącymi, oddzielonymi niewielką odległością.
Przepuścił również promienie katodowe przez jednolite pole magnetyczne, obserwując wpływ, jaki wywarło to na wiązkę. W jednym polu, a także w drugim, nastąpiło odchylenie promieni, co doprowadziło Thomsona do prawidłowego myślenia, że wiązka składa się z naładowanych cząstek.
Aby to zweryfikować, Thomson zastosował kilka strategii z promieniami katodowymi:
- Zmieniał pola elektryczne i magnetyczne, aż siły ustały. W ten sposób promienie katodowe przechodziły bez odchylenia. Porównując siły elektryczne i magnetyczne, Thomson był w stanie określić prędkość cząstek w wiązce.
- Anulował on natężenie pola elektrycznego, w ten sposób cząstki podążały po kołowej ścieżce w środku pola magnetycznego.
- Połączył wyniki kroków 1 i 2, aby określić stosunek ładunku do masy „ciałek”..
Stosunek ładunku do masy elektronu
Thomson ustalił, że stosunek ładunku do masy cząstek składających się na wiązkę promieniowania katodowego ma następującą wartość:
q / m = 1,758820 x 10 11 C. kg-1.
Gdzie q reprezentuje ładunek „ciałka”, który w rzeczywistości jest elektronem i m jest tego masa. Thomson postępował zgodnie z procedurą opisaną w poprzedniej sekcji, którą tutaj odtwarzamy krok po kroku, stosując równania, których użył.

Krok 1
Wyrównaj siłę elektryczną i siłę magnetyczną, przepuszczając wiązkę przez prostopadłe pola elektryczne i magnetyczne:
qvB = qE
Krok 2
Określ prędkość uzyskiwaną przez cząstki w wiązce, gdy przechodzą bezpośrednio bez ugięcia:
v = E / B
Krok 3
Anuluj pole elektryczne, pozostawiając tylko pole magnetyczne (teraz jest odchylenie):
R = mv / qB
Z v = E / B wynika:
R = mE / qBdwa
W związku z tym można zmierzyć promień orbity:
q / m = v / RB
No cóż:
q / m = E / RBdwa
Następne kroki
Następną rzeczą, jaką zrobił Thomson, był pomiar stosunku q / m przy użyciu katod wykonanych z różnych materiałów. Jak wspomniano wcześniej, wszystkie metale emitują promienie katodowe o identycznych właściwościach..
Następnie Thomson porównał jego wartości z wartościami stosunku q / m jonu wodorowego, uzyskanego w wyniku elektrolizy, którego wartość wynosi około 1 x 108 C / kg. Stosunek ładunku do masy elektronu jest około 1750 razy większy niż jonu wodorowego.
Dlatego promienie katodowe miały znacznie większy ładunek lub być może masę znacznie mniejszą niż masa jonu wodorowego. Jon wodorowy jest po prostu protonem, o którego istnieniu dowiedzieliśmy się długo po eksperymentach Rutherforda z rozpraszaniem..
Dziś wiadomo, że proton jest prawie 1800 razy masywniejszy od elektronu i ma ładunek o tej samej wielkości i znaku przeciwnym do elektronu..
Innym ważnym szczegółem jest to, że eksperymenty Thomsona nie określiły bezpośrednio ładunku elektrycznego elektronu ani osobno wartości jego masy. Wartości te zostały określone w eksperymentach Millikana, które rozpoczęły się w 1906 roku..
Różnice między modelami Thomsona i Daltona
Podstawowa różnica między tymi dwoma modelami polega na tym, że Dalton uważał, że atom jest kulą. W przeciwieństwie do Thomsona nie proponował istnienia ładunków dodatnich ani ujemnych. Dla Daltona atom wyglądał następująco:

Jak widzieliśmy wcześniej, Thomson uważał, że atom jest podzielny, a jego strukturę tworzy dodatnia sfera i elektrony wokół.
Modelowe wady i ograniczenia
W tamtym czasie model atomowy Thomsona zdołał bardzo dobrze wyjaśnić chemiczne zachowanie substancji. Prawidłowo wyjaśnił również zjawiska, które zachodziły w lampie elektronopromieniowej.
W rzeczywistości Thomson nawet nie nazwał swoich cząstek „elektronami”, chociaż termin ten został już wcześniej ukuty przez George'a Johnstone'a Stoneya. Thomson nazwał je po prostu „ciałkami”..
Chociaż Thomson wykorzystał całą dostępną mu wówczas wiedzę, jego model ma kilka ważnych ograniczeń, które ujawniły się bardzo wcześnie:
-Ładunek dodatni nie jest rozprowadzany po całym atomie. Eksperymenty z rozpraszaniem Rutherforda wykazały, że dodatni ładunek atomu jest siłą rzeczy ograniczony do małego obszaru atomu, który później stał się znany jako jądro atomowe..
-Elektrony mają określony rozkład w każdym atomie. Elektrony nie są rozmieszczone równomiernie, jak rodzynki w słynnym puddingu, ale mają układ na orbitali, który ujawnił późniejsze modele.
To właśnie układ elektronów w atomie umożliwia uporządkowanie pierwiastków według ich charakterystyk i właściwości w układzie okresowym. Było to ważne ograniczenie modelu Thomsona, które nie potrafiło wyjaśnić, jak można tak uporządkować elementy..
-Jądro atomowe to to, które zawiera większość masy. Model Thomsona zakładał, że masa atomu jest w nim równomiernie rozłożona. Ale dzisiaj wiemy, że masa atomu jest praktycznie skoncentrowana w protonach i neutronach jądra..
Należy również zauważyć, że ten model atomu nie pozwolił wywnioskować typu ruchu, jaki miały elektrony w atomie..
Ciekawe artykuły
Model atomowy Schrödingera.
Model Atomic de Broglie.
Model atomowy Chadwicka.
Model atomowy Heisenberga.
Model atomowy Perrina.
Model atomowy Daltona.
Model atomowy Diraca Jordana.
Atomowy model Demokryta.
Model atomowy Leucippus.
Model atomowy Bohra.
Model atomowy Sommerfelda.
Aktualny model atomowy.
Bibliografia
- Andriessen, M. 2001. Kurs HSC. Fizyka 2. Jacaranda HSC Science.
- Arfken, G. 1984. Fizyka uniwersytecka. Academic Press.
- Knight, R. 2017. Fizyka dla naukowców i inżynierii: podejście strategiczne. osoba.
- Rex, A. 2011. Podstawy fizyki. osoba.
- Wikipedia. Model atomowy Thomsona. Odzyskane z: es.wikipedia.org.


Jeszcze bez komentarzy