
Formuły, właściwości, zastosowania i zagrożenia azotanu glinu
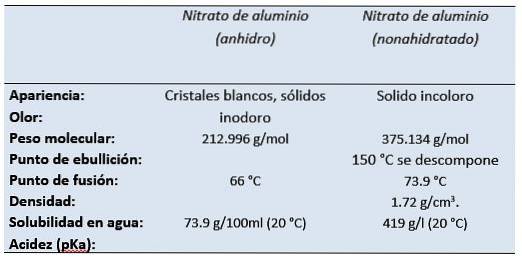
Plik azotan glinu Jest to sól glinowa kwasu azotowego. Nonahydrat azotanu glinu w temperaturze pokojowej pojawia się jako bezbarwne ciało stałe o zapachu kwasu azotowego..
Nie są palne, ale mogą przyspieszyć spalanie materiałów palnych. W przypadku dużych ilości azotanu glinu lub drobnego rozdrobnienia materiału palnego może dojść do wybuchu..

Długotrwałe narażenie na ogień lub ciepło może doprowadzić do wybuchu. Kiedy wchodzą w kontakt z ogniem, wytwarzają tlenki azotu. Jego zastosowania obejmują rafinację ropy naftowej oraz barwienie i garbowanie skóry..
Jest to biała, rozpuszczalna w wodzie sól, która najczęściej występuje w postaci krystalicznej, niewodnej (azotan glinu, bezwodny)..
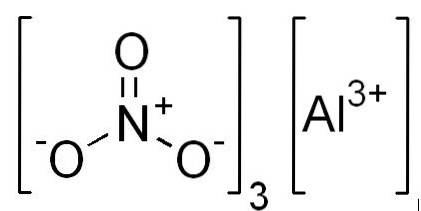
Indeks artykułów
- 1 Formuły
- 2 Struktura
- 2.1 W 2D
- 2.2 W 3D
- 3 Właściwości fizyczne i chemiczne
- 3.1 Alerty o reaktywności
- 3.2 Reakcje z powietrzem i wodą
- 3.3 Palność
- 3.4 Reaktywność
- 3.5 Toksyczność
- 4 Zastosowania
- 5 Efekty kliniczne
- 6 Bezpieczeństwo i zagrożenia
- 6.1 Klasy zagrożenia GHS
- 6.2 Kody zwrotów wskazujących środki ostrożności
- 7 Referencje
Formuły
- Azotan glinu: Al (NO3)3
- Nonahydrat azotanu glinu: Al (NO3)3 9HdwaLUB
- CAS: 13473-90-0 Azotan glinu (bezwodny)
- CAS: 14797-65-0 Azotan glinu (bezwodny)
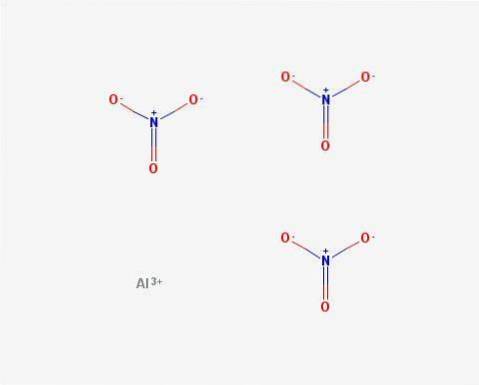
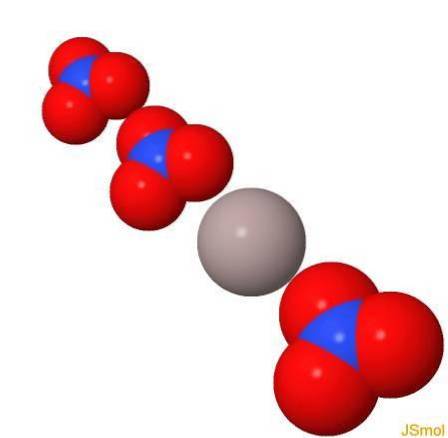
Struktura
W 2D
W 3D
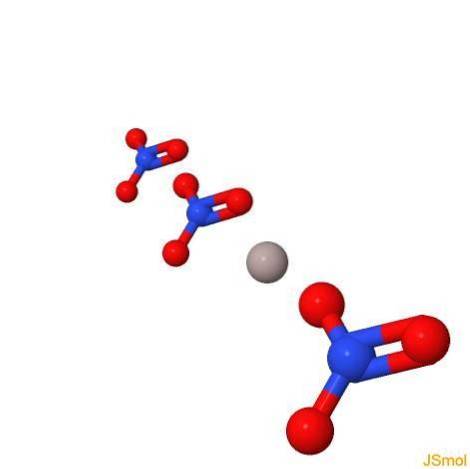
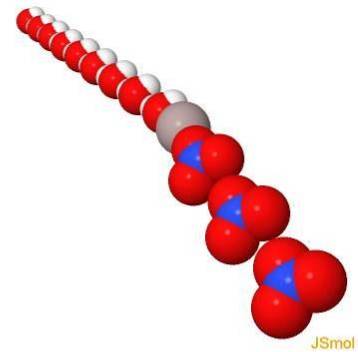
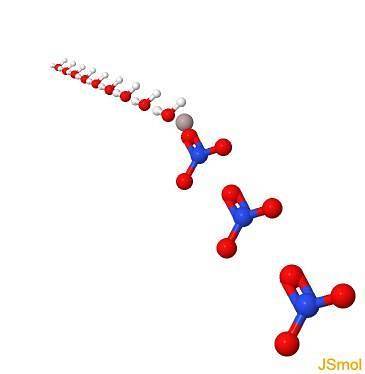
Fizyczne i chemiczne właściwości
- Azotan glinu należy do reaktywnej grupy nieorganicznych związków azotanowo-azotynowych.
- Jon azotanowy jest jonem wieloatomowym o wzorze cząsteczkowym NO3 - i stanowi sprzężoną zasadę kwasu azotowego.
- Prawie wszystkie nieorganiczne sole azotanowe są rozpuszczalne w wodzie w standardowej temperaturze i ciśnieniu..
- Związki azotanowe mają szeroki zakres zastosowań w oparciu o ich aktywność jako utleniaczy, obecność swobodnie dostępnego azotu lub ich wysoką rozpuszczalność..
Alerty reaktywności
Azotan glinu jest silnym utleniaczem.
Reakcje z powietrzem i wodą
Azotan glinu rozpływa się (ma właściwość pochłaniania wilgoci z powietrza do postaci roztworu wodnego). Jest rozpuszczalny w wodzie. Jego wodne roztwory są kwaśne.
Zapalność
Azotany i azotyny są związkami wybuchowymi. Niektóre z tych substancji mogą rozkładać się wybuchowo podczas ogrzewania lub w przypadku pożaru. Mogą eksplodować pod wpływem ciepła lub zanieczyszczenia. Kontenery mogą wybuchnąć po podgrzaniu.
Szczególne zagrożenia ze strony produktów spalania: toksyczne tlenki azotu mogą tworzyć się w pożarze z udziałem azotanu glinu.
Reaktywność
Azotany i azotyny mogą działać jako niezwykle silne utleniacze, a mieszaniny z czynnikami redukującymi lub zredukowanymi materiałami, takimi jak substancje organiczne, mogą być wybuchowe. Reaguj z kwasami, tworząc toksyczny dwutlenek azotu.
Ogólnie rzecz biorąc, sole azotanowe i azotynowe z aktywnymi kationami redoks (metale przejściowe i metale z grupy 3a, 4a i 5a układu okresowego, a także kation amonowy [NH4] +) są bardziej reaktywne z materiałami i czynnikami organicznymi. w warunkach otoczenia.
Azotan glinu jest środkiem utleniającym. Mieszaniny z estrami alkilowymi mogą eksplodować. Mieszaniny z fosforem, chlorkiem cyny (II) lub innymi czynnikami redukującymi mogą reagować wybuchowo.
Toksyczność
Ludzie są narażeni na toksyczność azotanów i azotynów, a dzieci są szczególnie podatne na methemoglobinemię.
Spożycie dużych dawek azotanu glinu powoduje podrażnienie żołądka, nudności, wymioty i biegunkę. Kontakt z pyłem podrażnia oczy i skórę.
Aplikacje
Azotany i azotyny są szeroko stosowane (i w bardzo dużych ilościach) jako nawozy w rolnictwie ze względu na ich skłonność do rozkładania i uwalniania azotu do wzrostu roślin oraz ze względu na ich rozpuszczalność, która umożliwia wchłanianie jonów azotanowych przez korzenie rośliny.
Związki azotanów są również szeroko stosowane jako surowiec przemysłowy, gdy wymagany jest środek utleniający lub źródło jonów azotanowych..
Azotan glinu jest używany do produkcji chemikaliów laboratoryjnych, kosmetycznych i higieny osobistej. W przemyśle jest używany jako półprodukt do produkcji innych substancji.
Jest stosowany w garbarstwie skór, w antyperspirantach, inhibitorach korozji, przy ekstrakcji uranu, rafinacji ropy naftowej oraz jako środek nitrujący..
Nonahydrat azotanu glinu i inne uwodnione azotany glinu mają wiele zastosowań. Sole te są wykorzystywane do produkcji tlenku glinu do wytwarzania papierów izolacyjnych, w elementach grzejnych lamp katodowych oraz w rdzeniach laminatów transformatorów. Sole uwodnione są również używane do ekstrakcji pierwiastków aktynidowych.
Efekty kliniczne
Aluminium jest wszechobecne, jest metalem występującym w największej ilości w skorupie ziemskiej. Większość narażenia ludzi pochodzi z pożywienia. Występuje w niektórych produktach farmaceutycznych. W przemyśle jest szeroko stosowany.
Glin hamuje przebudowę kości, powodując osteomalację. Uważa się, że hamuje erytropoezę, powodując anemię.
Ostre zatrucie jest rzadkie. Rozpuszczalne formy glinu mają większy potencjał toksyczności niż formy nierozpuszczalne ze względu na ich większą absorpcję..
Pacjenci z niewydolnością nerek są podatni na toksyczność glinu, pochodzącego albo z glinu w dializacie, albo z innych źródeł egzogennych, zwłaszcza środków wiążących fosforany i leków zobojętniających sok żołądkowy zawierających glin..
Przewlekłe narażenie na pył aluminiowy może powodować duszność, kaszel, zwłóknienie płuc, odmę opłucnową, pylicę płuc, encefalopatię, osłabienie, brak koordynacji i napady padaczkowe..
Sole glinu mogą powodować podrażnienia oczu i błon śluzowych, zapalenie spojówek, dermatozę i egzemę..
Chociaż glin i jego związki wykazały niewiele dowodów na rakotwórczość u ludzi, narażenie na inne substancje biorące udział w produkcji aluminium wiąże się z rakotwórczością..
Bezpieczeństwo i ryzyko
Zwroty wskazujące rodzaj zagrożenia Globalnie Zharmonizowanego Systemu Klasyfikacji i Oznakowania Chemikaliów (GHS).
Globalnie Zharmonizowany System Klasyfikacji i Oznakowania Chemikaliów (GHS) to system uzgodniony na szczeblu międzynarodowym, stworzony przez Organizację Narodów Zjednoczonych i zaprojektowany w celu zastąpienia różnych norm klasyfikacji i oznakowania stosowanych w różnych krajach poprzez stosowanie spójnych kryteriów na całym świecie..
Klasy zagrożenia (i odpowiadający im rozdział GHS), normy klasyfikacji i oznakowania oraz zalecenia dotyczące azotanu glinu i bezwodnego azotanu glinu są następujące (Europejska Agencja Chemikaliów, 2017; Organizacja Narodów Zjednoczonych, 2015; PubChem, 2017):
Klasy zagrożeń GHS
H272: Może intensyfikować pożar; Utleniacz [Ostrzeżenie Płyny utleniające; Substancje stałe utleniające - kategoria 3] (PubChem, 2017).
H301: Działa toksycznie po połknięciu [Zagrożenie ostrą toksycznością, doustnie - kategoria 3] (PubChem, 2017).
H315: Działa drażniąco na skórę [Uwaga Działanie żrące / drażniące na skórę - Kategoria 2] (PubChem, 2017).
H318: Powoduje poważne uszkodzenie oczu [Niebezpieczeństwo Poważne uszkodzenie oczu / działanie drażniące na oczy - Kategoria 1] (PubChem, 2017).
H319: Działa drażniąco na oczy [Ostrzeżenie Poważne uszkodzenie oczu / działanie drażniące na oczy - Kategoria 2A] (PubChem, 2017).
Kody zwrotów wskazujących środki ostrożności
P210, P220, P221, P264, P270, P280, P301 + P310, P302 + P352, P305 + P351 + P338, P310, P321, P330, P332 + P313, P337 + P313, P362, P370 + P378, P405 i P501 (PubChem, 2017).





Bibliografia
- ChemIDplus (2017) Struktura 3D 13473-90-0 - azotan glinu [zdjęcie] Źródło: chem.nlm.nih.gov.
- ChemIDplus (2017) Struktura 3D 7784-27-2 - Nonahydrat azotanu glinu [zdjęcie] Odzyskano z: chem.nlm.nih.gov.
- Daisa, J. (2017) Shell Oil Refinery at Dusk [zdjęcie] Odzyskane z: flickr.com.
- Edgar181 (2008) azotan glinu [zdjęcie]. Odzyskane z: wikipedia.org.
- Europejska Agencja Chemikaliów (ECHA). (2016). Azotan glinu. Krótki profil. Pobrane 8 lutego 2017 r. Z echa.europa.eu.
- Bank danych o substancjach niebezpiecznych (HSDB). TOXNET. (2017). Azotan glinu. Bethesda, MD, UE: National Library of Medicine. Odzyskany z: chem.nlm.nih.gov.
- JSmol (2017) Azotan [obraz] Odzyskany z: chemapps.stolaf.edu.
- Wikipedia. (2017). Azotan glinu. Pobrano 8 lutego 2017 z: wikipedia.org.
- Wikipedia. (2017). Nonahydrat azotanu glinu. Pobrano 8 lutego 2017 z: wikipedia.org.



Jeszcze bez komentarzy