
Struktura, właściwości, zastosowanie azotanu magnezu (Mg (NO3) 2)

Plik azotan magnezu jest nieorganicznym ciałem stałym, którego wzór chemiczny to Mg (NO3)dwa. Jest to związek jonowy powstały w wyniku połączenia kationu magnezu Mgdwa+ i dwa aniony azotanowe NO3-.
Mg (NO3)dwa jest to biała krystaliczna substancja stała. Jest bardzo higroskopijny, to znaczy łatwo wchłania wodę z otoczenia. Pozostając w kontakcie z otaczającym powietrzem, ma tendencję do tworzenia heksahydratu Mg (NO3)dwa•6HdwaLUB.

Sześciowodzian azotanu magnezu Mg (NO3)dwa•6HdwaO ma w swojej strukturze krystalicznej 6 cząsteczek wody H.dwaLub dla każdej cząsteczki Mg (NO3)dwa. Azotan magnezu występuje w jaskiniach i kopalniach w postaci minerału nitromagnezytu.
Mg (NO3)dwa otrzymywany w handlu w wyniku reakcji metalicznego magnezu Mg z kwasem azotowym HNO3.
Ma szerokie zastosowanie, na przykład w rolnictwie jako nawóz, ponieważ dostarcza roślinom składników odżywczych, takich jak azot (N) i magnez (Mg)..
Znajduje zastosowanie w przemyśle pirotechnicznym, pirotechnicznym, a także do otrzymywania stężonego kwasu azotowego. Stosowany w analizie chemicznej, eksperymentach fizycznych oraz badaniach medycznych i naukowych.
Indeks artykułów
- 1 Struktura
- 2 Nazewnictwo
- 3 Właściwości
- 3.1 Stan fizyczny
- 3.2 Masa cząsteczkowa
- 3.3 Temperatura topnienia
- 3.4 Temperatura wrzenia
- 3.5 Gęstość
- 3.6 Rozpuszczalność
- 3.7 Wpływ ogrzewania
- 4 Otrzymywanie
- 4.1 Lokalizacja w przyrodzie
- 5 zastosowań
- 5.1 W ostatnich badaniach
- 5.2 W badaniach nad chorobami
- 6 Odnośniki
Struktura
Bezwodny azotan magnezu składa się z kationu magnezu Mgdwa+ i dwa aniony azotanowe NO3-.
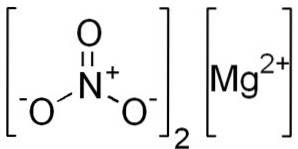
Jon magnezu Mgdwa+ posiada konfigurację elektronową: 1sdwa, 2sdwa 2 P6, 3s0, ponieważ wydał dwa elektrony z najbardziej zewnętrznej powłoki (3s). Ta konformacja jest bardzo stabilna.
Jon NO3- ma płaską i symetryczną konstrukcję.
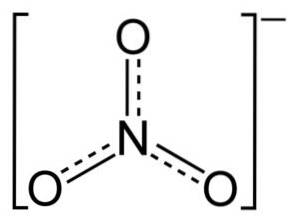
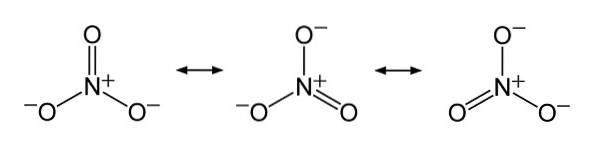
W strukturze NO3- ładunek ujemny jest stale rozprowadzany między trzema atomami tlenu.
Nomenklatura
-Bezwodny azotan magnezu: Mg (NO3)dwa
-Azotan magnezu dwuwodny: Mg (NO3)dwa•2HdwaLUB
-Sześciowodzian azotanu magnezu: Mg (NO3)dwa•6HdwaLUB
-Diazotan magnezu
Nieruchomości
Stan fizyczny
-Mg (NO3)dwa bezwodny: białe ciało stałe, sześcienne kryształy.
-Mg (NO3)dwa dwuwodzian: biała krystaliczna substancja stała.
-Mg (NO3)dwa heksahydrat: bezbarwne ciało stałe, jednoskośne kryształy
Waga molekularna
-Mg (NO3)dwa bezwodny: 148,31 g / mol
-Mg (NO3)dwa heksahydrat: 256,41 g / mol
Temperatura topnienia
-Mg (NO3)dwa sześciowodzian: 88,9 ° C
Temperatura wrzenia
-Mg (NO3)dwa heksahydrat: nie wrze, rozkłada się w temperaturze 330 ºC
Gęstość
-Mg (NO3)dwa bezwodny: 2,32 g / cm3
-Mg (NO3)dwa dwuwodzian: 1,456 g / cm3
-Mg (NO3)dwa sześciowodzian: 1464 g / cm3
Rozpuszczalność
Bezwodny azotan magnezu jest bardzo dobrze rozpuszczalny w wodzie: 62,1 g / 100 ml w temperaturze 0 ºC; 69,5 g / 100 ml w temperaturze 20 ° C Jest również bardzo higroskopijny, w kontakcie z powietrzem szybko tworzy heksahydrat.
Mg (NO3)dwa dwuwodzian jest również bardzo dobrze rozpuszczalny w wodzie i etanolu. Jest higroskopijny.
Mg (NO3)dwa heksahydrat jest również bardzo dobrze rozpuszczalny w wodzie. Jest umiarkowanie rozpuszczalny w etanolu. Jest najbardziej stabilny z trzech w kontakcie z powietrzem, to znaczy z trzech jest tym, który pochłania najmniej wody z otoczenia.
Efekt ogrzewania
Poddając wodny roztwór Mg (NO3)dwa Po odparowaniu wody krystalizującą solą jest heksahydrat: Mg (NO3)dwa•6HdwaO. Sześciowodzian oznacza, że w stanie stałym każda cząsteczka Mg (NO3)dwa wiąże się z 6 cząsteczkami wody.
Istnieje również dwuwodzian Mg (NO3)dwa•2HdwaLub, w którym Mg (NIE3)dwa ciało stałe jest związane z 2 cząsteczkami wody.
Ogrzewanie heksahydratu Mg (NO3)dwa•6HdwaLub nie otrzymuje się bezwodnej soli, ponieważ azotan magnezu ma duże powinowactwo do wody.
Z tego powodu po podgrzaniu powyżej temperatury topnienia początkowo tworzy mieszaną sól azotanu magnezu i wodorotlenku Mg (NO3)dwa•4Mg (OH)dwa.
Ta mieszana sól po osiągnięciu 400 ° C rozkłada się na tlenek magnezu MgO i uwalniane są gazy tlenkowe azotu..
Otrzymywanie
Można go otrzymać w reakcji węglanu magnezu MgCO3 z kwasem azotowym HNO3, wydzielający dwutlenek węgla COdwa:
MgCO3 + 2 HNO3 → Mg (NO3)dwa + WSPÓŁdwa↑ + HdwaLUB
Można go również otrzymać z wodorotlenkiem magnezu Mg (OH)dwa i kwas azotowy:
Mg (OH)dwa + 2 HNO3 → Mg (NO3)dwa + 2 godzdwaLUB
Komercyjnie uzyskuje się go na kilka sposobów:
1- Reagowanie metalicznego magnezu Mg z kwasem azotowym HNO3.
2- Reagując tlenek magnezu MgO z kwasem azotowym HNO3.
3- Wiązanie wodorotlenku magnezu Mg (OH)dwa i azotan amonu NH4NIE3, tworzenie azotanu magnezu z wydzielaniem amoniaku NH3.
Lokalizacja w przyrodzie
Mg (NO3)dwa heksahydrat występuje naturalnie w kopalniach i jaskiniach lub kawernach w postaci minerału nitromagnezytu.
Ten minerał jest obecny, gdy guano wchodzi w kontakt ze skałami bogatymi w magnez. Guano to materiał powstający z odchodów ptaków morskich i fok w bardzo suchym środowisku..
Aplikacje
Mg (NO3)dwa heksahydrat jest stosowany w przemyśle ceramicznym, chemicznym i rolniczym.
Związek ten jest nawozem, ponieważ dostarcza azot (N), który jest jednym z trzech podstawowych pierwiastków potrzebnych roślinom oraz magnez (Mg), który jest składnikiem drugorzędnym, również ważnym dla roślin..
W ten sposób jest używany z innymi składnikami w szklarniach i uprawach hydroponicznych. Ta ostatnia polega na uprawie roślin w roztworze wodnym z solami nawozowymi zamiast gleby.

Znajduje również zastosowanie jako katalizator w otrzymywaniu związków petrochemicznych. Pozwala na dostosowanie lepkości w określonych procesach. Bezwodny azotan magnezu stosowany jest w pirotechnice, czyli do produkcji fajerwerków.

Bezwodny azotan magnezu jest środkiem odwadniającym. Służy np. Do otrzymywania stężonego kwasu azotowego, ponieważ eliminuje wodę i koncentruje opary kwaśne do 90-95% HNO3.

Służy również do powlekania azotanu amonu i umożliwia tworzenie się kulek tego sprasowanego materiału..
Jest przydatny w formułowaniu tuszy, tonerów (czarny proszek używany w systemach kserograficznych) i produktów koloryzujących. Służy jako wzorzec magnezu w chemii analitycznej.
Sól azotanu magnezu i Mg ceru (NO3)dwa•Marszczyć brwi3)3 Jest interesujący w eksperymentach fizycznych w niskich temperaturach, ponieważ jest stosowany jako chłodziwo w eksperymentach adiabatycznej demagnetyzacji (bez wymiany ciepła).
Ta sól magnezu i ceru została wykorzystana do ustalenia wyjątkowo niskich poziomów temperatury w skali Kelvina (bliskich zeru absolutnemu)..
W ostatnich badaniach
Kilku badaczy zastosowało Mg (NO3)dwa w kompozycjach z syntetycznymi i naturalnymi polimerami w celu zwiększenia przewodnictwa w akumulatorach z jonami magnezu.
Badano go również przy budowie superkondensatorów do magazynowania energii dużej mocy.
W badaniach nad chorobami
Azotan magnezu podawano szczurom laboratoryjnym z nadciśnieniem tętniczym (wysokim ciśnieniem) i stwierdzono, że skutecznie obniża ciśnienie krwi i łagodzi lub łagodzi skutki powikłań tej choroby.
Wykazał również działanie ochronne przed zaburzeniami neurologicznymi (zaburzeniami neuronalnymi) i przed śmiercią u szczurów podczas procesów zatykania tętnicy szyjnej..
Bibliografia
- Qian, M. i in. (2018). Nadzwyczajne, porowate, kilkuwarstwowe węgle o dużej pojemności ze spalania żelu azotanu magnezu Pechini. Interfejsy ACS Appl Mater 2018, 10 (1): 381-388. Odzyskany z ncbi.nlm.nih.gov.
- Manjuladevi, R. i in. (2018). Badanie mieszanki elektrolitu polimerowego na bazie poli (alkoholu winylowego) -poly (akrylonitrylu) z azotanem magnezu do baterii magnezowej. Ionics (2018) 24: 3493. Odzyskany z link.springer.com.
- Kiruthika, S. i in. (2019). Ekologiczny elektrolit biopolimerowy, pektyna z solą azotanu magnezu, do stosowania w urządzeniach elektrochemicznych. J Solid State Electrochem (2019) 23: 2181. Odzyskany z link.springer.com.
- Vilskerts R. i in. (2014). Azotan magnezu osłabia wzrost ciśnienia krwi u szczurów SHR. Magnes Res 2014, 27 (1): 16–24. Odzyskany z ncbi.nlm.nih.gov.
- Kuzenkov V.S. i Krushinskii A.L. (2014). Ochronne działanie azotanu magnezu na zaburzenia neurologiczne wywołane niedokrwieniem mózgu u szczurów. Bull Exp Biol Med 2014, 157 (6): 721-3. Odzyskany z ncbi.nlm.nih.gov.
- Ropp, R.C. (2013). Związki ziem alkalicznych z grupy 15 (N, P, As, Sb i Bi). Azotan Magnezu. W Encyclopedia of the Alkaline Earth Compounds. Odzyskany z sciencedirect.com.
- Kirk-Othmer (1994). Encyklopedia technologii chemicznej. Tom 1. Wydanie czwarte. John Wiley & Sons.
- NAS. National Library of Medicine. (2019). Azotan Magnezu. Odzyskany z: pubchem.ncbi.nlm.nih.gov.



Jeszcze bez komentarzy