
Liczba masowa, z czego się składa i jak ją zdobyć (z przykładami)

Plik Liczba masowa Liczba masowa atomu to suma liczby protonów i liczby neutronów w jądrze. Te cząstki są oznaczane zamiennie nazwą nukleony, dlatego liczba masowa reprezentuje ich ilość.
Niech N będzie liczbą obecnych neutronów, a Z liczbą protonów, jeśli nazwiemy A jako liczbę masową, to:
A = N + Z
Indeks artykułów
- 1 Przykłady liczb masowych
- 1.1 Wodór
- 1.2 Tlen
- 1.3 Węgiel
- 1.4 Uran
- 2 Jak uzyskać liczbę masową?
- 2.1 Notacja atomów
- 3 izotopy
- 3.1 Izotopy węgla
- 4 przykłady praktyczne
- 4.1 - Przykład 1
- 4.2 - Przykład 2
- 5 Referencje
Przykłady liczb masowych
Oto kilka przykładów liczb masowych dla dobrze znanych pierwiastków:
Wodór
Najbardziej stabilny i rozpowszechniony atom wodoru jest również najprostszy: 1 proton i jeden elektron. Ponieważ jądro wodoru nie ma neutronów, prawdą jest, że A = Z = 1.
Tlen
Jądro tlenu ma 8 neutronów i 8 protonów, więc A = 16.
Węgiel
Życie na Ziemi opiera się na chemii węgla, lekkiego atomu z 6 protonami w jądrze plus 6 neutronów, więc A = 6 + 6 = 12.
Uran
Ten pierwiastek, znacznie cięższy niż poprzednie, jest dobrze znany ze swoich właściwości radioaktywnych. Jądro uranu ma 92 protony i 146 neutronów. Wtedy jego liczba masowa wynosi A = 92 + 146 = 238.
Jak uzyskać liczbę masową?
Jak wspomniano wcześniej, liczba masowa A pierwiastka zawsze odpowiada sumie liczby protonów i liczby neutronów, które zawiera jego jądro. Jest to również liczba całkowita, ale ... czy jest jakaś zasada dotycząca związku między dwiema wielkościami??
Zobaczmy: wszystkie wymienione wyżej pierwiastki są lekkie, z wyjątkiem uranu. Jak powiedzieliśmy, atom wodoru jest najprostszy. Nie ma neutronów, przynajmniej w swojej najliczniejszej wersji, aw tlenie i węglu jest równa liczba protonów i neutronów.
Dzieje się tak również z innymi lekkimi pierwiastkami, takimi jak azot, inny bardzo ważny dla życia gaz, który ma 7 protonów i 7 neutronów. Jednak w miarę jak jądro staje się bardziej złożone, a atomy cięższe, liczba neutronów rośnie w różnym tempie..
W przeciwieństwie do lekkich pierwiastków, uran z 92 protonami ma około 1 ½ razy większą ilość neutronów: 1 ½ x 92 = 1,5 x 92 = 138.
Jak widać, jest to dość blisko 146, czyli liczby neutronów, które ma.
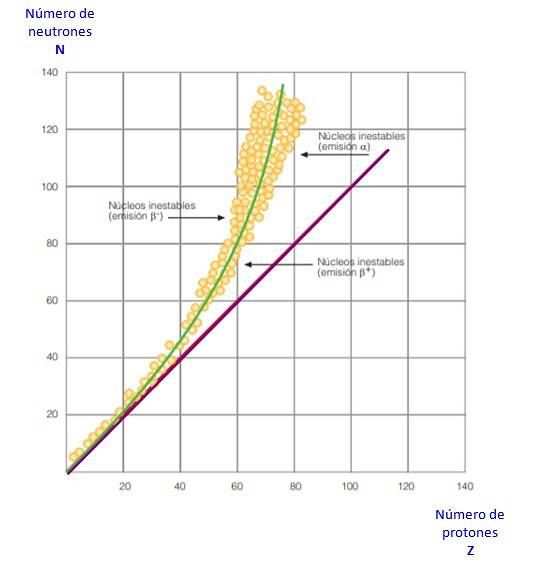
Wszystko to jest widoczne na krzywej na rysunku 2. Jest to wykres zależności N od Z, znany jako krzywa stabilności jądrowej. Można tam zobaczyć, jak lekkie atomy mają taką samą liczbę protonów jak neutrony i jak od Z = 20 liczba neutronów wzrasta..
W ten sposób duży atom staje się bardziej stabilny, ponieważ nadmiar neutronów zmniejsza odpychanie elektrostatyczne między protonami..
Notacja dla atomów
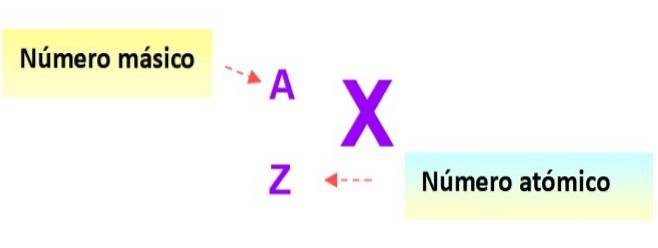
Bardzo przydatna notacja, która szybko opisuje rodzaj atomu, jest następująca: symbol pierwiastka oraz odpowiednie liczby atomowe i masowe są zapisane tak, jak pokazano poniżej na tym schemacie:
W tym zapisie atomy w poprzednich przykładach wyglądałyby następująco:
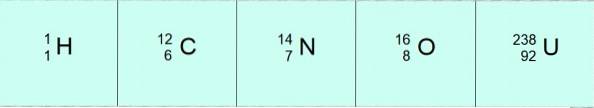
Czasami używa się innego wygodniejszego zapisu, w którym do oznaczenia atomu używa się tylko symbolu pierwiastka i liczby masowej, pomijając liczbę atomową. W ten sposób 12 6C jest po prostu zapisane jako węgiel-12, the 16 8Albo byłby to tlen-16 i tak dalej dla dowolnego pierwiastka.
Izotopy
Liczba protonów w jądrze determinuje naturę pierwiastka. Na przykład każdy atom, którego jądro zawiera 29 protonów, jest atomem miedzi, bez względu na wszystko..
Załóżmy, że atom miedzi z jakiegoś powodu traci elektron, nadal jest to miedź. Jednak teraz jest to zjonizowany atom.
Jądrowi atomowemu trudniej jest zdobyć lub stracić proton, ale w naturze może się to zdarzyć. Na przykład w gwiazdach cięższe pierwiastki są stale formowane z lekkich pierwiastków, ponieważ jądro gwiazdy zachowuje się jak reaktor termojądrowy..
I właśnie tutaj na Ziemi występuje zjawisko rozpad radioaktywny, w którym niektóre niestabilne atomy wyrzucają nukleony i emitują energię, przekształcając się w inne pierwiastki.
Wreszcie istnieje możliwość, że atom określonego pierwiastka ma inną liczbę masową, w tym przypadku jest to a izotop.
Dobrym przykładem jest dobrze znany węgiel-14 lub radiowęglowodór, który służy do datowania obiektów archeologicznych i jako znacznik biochemiczny. To ten sam węgiel, o identycznych właściwościach chemicznych, ale z dwoma dodatkowymi neutronami.
Węgiel-14 występuje w mniejszych ilościach niż węgiel-12, stabilny izotop, a także jest radioaktywny. Oznacza to, że z czasem rozpada się emitując energię i cząsteczki, aż stanie się stabilnym pierwiastkiem, którym w jego przypadku jest azot..
Izotopy węgla
Węgiel występuje w przyrodzie jako mieszanina kilku izotopów, z których najliczniejszy jest wspomniany już 12 6C lub węgiel-12. A oprócz węgla-14 jest 13 6C z dodatkowym neutronem.
Jest to powszechne w przyrodzie, na przykład znanych jest 10 stabilnych izotopów cyny. Z drugiej strony, berylu i sodu znany jest tylko jeden izotop.
Każdy izotop, naturalny lub sztuczny, ma inną szybkość przemiany. W ten sam sposób w laboratorium możliwe jest tworzenie sztucznych izotopów, które są generalnie niestabilne i rozpadają się radioaktywnie w bardzo krótkim okresie ułamków sekundy, podczas gdy inne trwają znacznie dłużej, o ile wiek Ziemi lub więcej. ..
Tabela naturalnych izotopów węgla
| Izotopy węgla | Liczba atomowa Z | Numer masowy A | Obfitość% |
|---|---|---|---|
| 12 6 do | 6 | 12 | 98,89 |
| 13 6 do | 6 | 13 | 1.11 |
| 14 6 do | 6 | 14 | Ślady |
Przykłady opracowane
- Przykład 1
Jaka jest różnica pomiędzy 13 7 N i 14 7 N?
Odpowiedź
Oba są atomami azotu, ponieważ ich liczba atomowa wynosi 7. Jednak jeden z izotopów, ten z A = 13, ma o jeden neutron mniej, podczas gdy 14 7 N jest najbardziej rozpowszechnionym izotopem.
- Przykład 2
Ile neutronów znajduje się w jądrze atomu rtęci, oznaczono jako 201 80 Hg?
Odpowiedź
Ponieważ A = 201 i Z = 80, a także wiedząc, że:
A = Z + N
N = A - Z = 201 - 80 = 121
I wyciągnięto wniosek, że atom rtęci ma 121 neutronów.
Bibliografia
- Connor, N. Co to jest Nucleon - struktura jądra atomowego - definicja. Odzyskane z: periodic-table.org.
- Knight, R. 2017. Fizyka dla naukowców i inżynierii: podejście strategiczne. osoba.
- Sears, Zemansky. 2016. Fizyka uniwersytecka z fizyką współczesną. 14. Ed. Tom 2.
- Tippens, P. 2011. Fizyka: koncepcje i zastosowania. 7th Edition. Mcgraw hill.
- Wikipedia. Liczba masowa. Odzyskane z: en.wikipedia.org.


Jeszcze bez komentarzy