
Struktura, właściwości, zastosowania, zagrożenia, szczawian sodu (Na2C2O4)
Plik szczawian sodu Jest to związek organiczny składający się z dwóch jonów sodu i jednego jonu szczawianowego. Jego wzór chemiczny to NadwadodwaLUB4 lub też Nadwa(GRUCHAĆ)dwa. Jest to sól sodowa kwasu szczawiowego lub kwasu etanodiowego. NastępniedwadodwaLUB4 jest białą krystaliczną substancją stałą, a jej roztwory wodne są zasadowe (alkaliczne).
Szczawian sodu występuje w roślinach i warzywach. U ludzi kwas szczawiowy jest wytwarzany w sposób naturalny ze sprzężonego kwasu, który z kolei jest wytwarzany w wyniku pewnych procesów metabolicznych.

NastępniedwadodwaLUB4 Jest stosowany w laboratoriach analiz chemicznych jako środek redukujący (przeciwieństwo utleniacza). Również w celu umożliwienia badania niektórych związków organicznych podczas oczyszczania ścieków.
Służy do unieszkodliwiania odpadów chlorofluorowęglowodorów (CGC), które niszczą warstwę ozonową. Jest również surowcem do ekonomicznego pozyskiwania kwasu szczawiowego.
Ze względu na wysoką zawartość szczawianu sodu w niektórych warzywach jadalnych osoby, które mają skłonność do tworzenia się kamieni lub kamieni nerkowych, powinny unikać spożywania takich pokarmów. Dzieje się tak, ponieważ kamienie są zwykle utworzone ze szczawianów..
Indeks artykułów
- 1 Struktura
- 2 Nazewnictwo
- 3 Właściwości
- 3.1 Stan fizyczny
- 3.2 Masa cząsteczkowa
- 3.3 Gęstość
- 3.4 Rozpuszczalność
- 3,5 pH
- 3.6 Właściwości chemiczne
- 4 Otrzymywanie
- 4.1 Obecność w przyrodzie
- 5 zastosowań
- 5.1 W laboratoriach analiz chemicznych
- 5.2 Do niszczenia chlorofluorowęglowodorów
- 5.3 Przy określaniu ważnych parametrów oczyszczania ścieków
- 5.4 Aby otrzymać kwas szczawiowy
- 5.5 Aby usunąć niechciane związki
- 6 Ryzyka
- 7 Referencje
Struktura
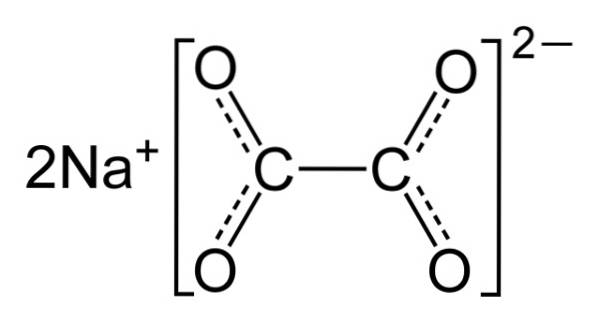
Szczawian sodu składa się z dwóch kationów sodu Na+ i anion szczawianowy (COO)dwadwa-. Z kolei anion szczawianowy składa się z dwóch jednostek COO- związane przez dwa atomy węgla: -OOC-COO-.
W stałym szczawianie sodu anion szczawianowy ma płaski kształt. Oznacza to, że węgle i tlenki są w tej samej płaszczyźnie..
Nomenklatura
- Szczawian sodu
- Szczawian disodu
- Sól sodowa kwasu etanodiowego
Nieruchomości
Stan fizyczny
Stały, biały krystaliczny.
Waga molekularna
134,0 g / mol
Gęstość
2,27 g / cm3 w 20 ° C.
Rozpuszczalność
Rozpuszczalny w wodzie: 3,7 g / 100 ml w 20 ° C.
pH
Jego wodne roztwory są zasadowe (alkaliczne), ponieważ anion szczawianowy ma tendencję do pobierania protonów z wody, pozostawiając wolne jony OH.-.
Właściwości chemiczne
Może neutralizować kwasy, a reakcje są egzotermiczne, to znaczy wydzielają ciepło.
Służy jako reduktor iw tych reakcjach wytwarza dwutlenek węgla COdwa.
Ma właściwość silnego wiązania różnych jonów metali, takich jak jony żelaza żelazawego Fedwa+ i żelazo Fe3+.
Otrzymywanie
Według konsultowanego źródła szczawian sodu można otrzymać utleniając węgiel tlenem O.dwa w temperaturze około 250 ° C w stężonym roztworze wodorotlenku sodu NaOH.
Obecność w przyrodzie
Szczawian sodu jest obecny w wielu roślinach i warzywach, takich jak boćwina, szpinak i rabarbar, a także w zbożach, takich jak soja, wśród wielu innych produktów roślinnych..

Jego sprzężony kwas, kwas szczawiowy, jest wytwarzany w ludzkim organizmie w wyniku metabolizmu kwasu glikolowego lub kwasu askorbinowego. Po wytworzeniu nie jest metabolizowany, ale jest wydalany z moczem w postaci szczawianu..

Aplikacje
W laboratoriach analiz chemicznych
Jest stosowany jako odczynnik chemiczny, ogólnie jako środek redukujący, na przykład do standaryzacji roztworów nadmanganianu potasu, to znaczy do dokładnego określenia, ile zawierają nadmanganianu sodu.
Podczas niszczenia chlorofluorowęglowodorów
Do niszczenia chlorofluorowęglanów (CFC) stosowano szczawian sodu. Te związki CFC są jednymi z odpowiedzialnych za zniszczenie warstwy ozonowej planety (która chroni nas przed promieniowaniem ultrafioletowym).
W 1996 roku niektórzy badacze zaproponowali użycie szczawianu sodu do ich eliminacji, ponieważ łatwo reaguje z CFC w temperaturach 270-290 ° C, czyniąc je nieszkodliwymi dla warstwy ozonowej..
Reakcję szczawianu sodu z CFC można kontrolować w celu uzyskania chlorowcowanych węglowodorów aromatycznych, które nie są szkodliwe dla warstwy ozonowej, ale są związkami użytecznymi w przemyśle chemicznym..
Wspomnianą reakcję można również zmaksymalizować i przekształcić wszystkie CFC w fluorek sodu NaF, chlorek sodu NaCl, węgiel elementarny i dwutlenek węgla CO.dwa.

Przy określaniu ważnych parametrów oczyszczania ścieków
Stwierdzono, że szczawian sodu jest przydatny do pomiaru ilości i rodzajów związków organicznych wydzielanych przez mikroorganizmy z szlamu używanego do oczyszczania ścieków..
Pomiar takich związków jest ważny dla określenia ich funkcji podczas oczyszczania ścieków, ponieważ od nich zależy łatwość oddzielenia szlamu od wody..
Stosowanie szczawianu sodu pozwala uniknąć wad innych metod.
Aby otrzymać kwas szczawiowy
Surowy szczawian sodu z niektórych odpadów procesowych był używany do produkcji kwasu szczawiowego H.dwadodwaLUB4 w dużych ilościach.
Metoda wykorzystuje szlam z procesu Bayera do obróbki boksytu (rudy aluminium). W procesie Bayera boksyt jest traktowany wodorotlenkiem sodu NaOH w celu rozpuszczenia tlenku glinu tego minerału.
W procesie rozpuszczania tlenku glinu niektóre związki organiczne obecne w minerale, takie jak kwasy humusowe, są atakowane przez NaOH, generując dużą ilość szczawianu sodu NadwadodwaLUB4.
Ten szczawian sodu jest wprowadzany do szlamu ze związkami glinu. W celu oczyszczenia całość rozpuszcza się, filtruje i przepuszcza przez kwaśną kolumnę jonowymienną..
W kolumnie znajduje się żywica kwasu sulfonowego RSO3H, w którym jony metali są wymieniane na Na+ przez jony wodoru H.+, więc otrzymujesz kwas szczawiowy H.dwadodwaLUB4.
RSO3H + NadwadodwaLUB4 ⇔ RSO3Na + NaHCdwaLUB4
RSO3H + NaHCdwaLUB4 ⇔ RSO3Na + HdwadodwaLUB4
Jest to niedrogi proces, a otrzymany kwas szczawiowy ma dopuszczalną czystość..
Aby usunąć niechciane związki
Sprzężony kwas szczawianu sodu, kwas szczawiowy H.dwadodwaLUB4, używany do rozpuszczania niektórych rodzajów gruzu i kamienia.
Wykorzystuje właściwości kwasu szczawiowego, aby przekształcić się w szczawian działający jako czynnik kompleksujący lub strącający, na przykład podczas przetwarzania odpadów z różnych paliw jądrowych.
Kwas szczawiowy jest również używany do usuwania kamienia mineralnego i tlenków żelaza w rurach i innym sprzęcie, wynika to z jego zdolności do silnego wiązania zarówno jonów żelazawych Fedwa+ co do jonu żelaza Fe3+ tworząc szczawiany.
Ryzyka
W przypadku bezpośredniego wdychania lub spożycia szczawian sodu powoduje ból gardła, przełyku i żołądka. Powoduje wymioty, silne przeczyszczanie, słaby puls, zapaść sercowo-naczyniową, objawy nerwowo-mięśniowe i uszkodzenie nerek.
Osoby, które mają skłonność do tworzenia się kamieni nerkowych w wyniku gromadzenia się szczawianów w moczu, powinny unikać spożywania warzyw o dużej zawartości rozpuszczalnych szczawianów, takich jak sód.
Szczawian sodu w dużych ilościach w pożywieniu przedostaje się do moczu, wiąże się z obecnym w nim wapniem i może powodować powstawanie kamieni lub kamieni szczawianu wapnia w nerkach u osób, które mają do tego skłonność..
Bibliografia
- NAS. National Library of Medicine. (2019). Szczawian sodu. Narodowe Centrum Informacji Biotechnologicznej. Odzyskany z pubchem.ncbi.nlm.nih.gov.
- Chai, W. i Liebman, M. (2005). Wpływ różnych metod gotowania na zawartość szczawianów w warzywach. J. Agric. Food Chem.2005, 53, 3027-3030. Odzyskany z pubs.acs.org.
- Dagani, R. (1996). Niszcząca reakcja CFC. Archiwum wiadomości z dziedziny chemii i inżynierii 1996, 74, 4, 6-7. Odzyskany z pubs.acs.org.
- Sajjad, M. i Kim, K.S. (2016). Ekstrakcja pozakomórkowych substancji polimerowych z osadu czynnego przy użyciu szczawianu sodu. Int. J. Environ. Sci. Technol. 13, 1697-1706 (2016). Odzyskany z link.springer.com.
- Jeffrey, G.A. i Parry, G.S. (1954). Struktura krystaliczna szczawianu sodu. J. Am Chem Soc. 1954, 76, 21, 5283-5286. Odzyskany z pubs.acs.org.
- Okuwaki, A. i in. (1984). Produkcja szczawianu przez utlenianie węgla tlenem w stężonym roztworze wodorotlenku sodu. Ind. Eng. Chem. Prod. Res. Dev. 1984, 23, 648-651. Odzyskany z pubs.acs.org.
- Hefter, G. i in. (2018). Rozpuszczalność szczawianu sodu w stężonych roztworach elektrolitów. J Chem & Eng Data. 2018, 63, 3, 542-552. Odzyskany z pubs.acs.org.
- The, K. I. (1992). Proces otrzymywania kwasu szczawiowego i wodoroszczawianu sodu z surowego szczawianu sodu. NAS. Patent nr 5,171,887. 15 grudnia 1992. Odzyskany z freepatentsonline.com.



Jeszcze bez komentarzy