
Wzory procesu izobarycznego, równania, eksperymenty, ćwiczenia
W proces izobaryczny, presja P. systemu pozostaje niezmienna. Przedrostek „iso” pochodzi z języka greckiego i jest używany do oznaczenia, że coś pozostaje niezmienne, podczas gdy „baros”, również z języka greckiego, oznacza wagę.
Procesy izobaryczne są bardzo typowe zarówno w zamkniętych pojemnikach, jak i na otwartych przestrzeniach, dzięki czemu można je łatwo zlokalizować w przyrodzie. Rozumiemy przez to, że możliwe są fizyczne i chemiczne zmiany na powierzchni ziemi lub reakcje chemiczne w pojemnikach otwartych do atmosfery..
Niektóre przykłady uzyskuje się przez ogrzewanie balonu wypełnionego powietrzem na słońcu, gotowanie, gotowanie lub zamrażanie wody, parę wytwarzaną w kotłach lub proces podnoszenia balonu na gorące powietrze. Później wyjaśnimy te przypadki.
Indeks artykułów
- 1 Formuła i równania
- 2 eksperymenty
- 2.1 Procesy izobaryczne w gazie idealnym
- 3 przykłady
- 3.1 Gotowanie wody i gotowanie
- 3.2 Zamrozić wodę
- 3.3 Ogrzewanie balonu wypełnionego powietrzem na słońcu
- 3.4 Balon na ogrzane powietrze
- 3.5 Kotły
- 4 ćwiczenia rozwiązane
- 4.1 Ćwiczenie 1
- 4.2 Ćwiczenie 2
- 5 Referencje
Formuła i równania
Wyprowadźmy równanie dla procesu izobarycznego, zakładając, że badany układ jest gazem idealnym, model całkiem odpowiedni dla prawie każdego gazu o ciśnieniu poniżej 3 atmosfer. Idealne cząsteczki gazu poruszają się losowo, zajmując całą objętość przestrzeni, która je zawiera, bez wzajemnych interakcji..
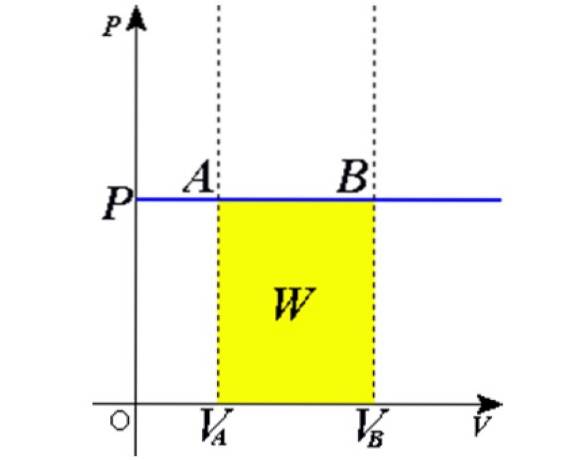
Jeśli pozwoli się, by gaz doskonały zamknięty w cylindrze wyposażonym w ruchomy tłok rozszerzał się powoli, można założyć, że jego cząstki są przez cały czas w równowadze. Następnie gaz oddziałuje na tłok o pow DO siła fa wielkości:
F = p.A
Gdzie p to ciśnienie gazu. Siła ta wywiera pracę powodując nieskończenie małe przemieszczenie dx na tłoku podany przez:
dW = Fdx = pA.dx
Jako produkt Adx jest różnicą objętości dV, następnie dW = pdV. Pozostaje zintegrować obie strony z początkowej objętości VDO do ostatecznej objętości Vb aby uzyskać całkowitą pracę wykonaną przez gaz:


Eksperymenty
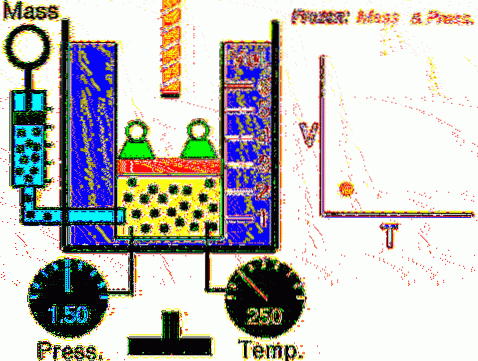
Opisana sytuacja jest weryfikowana eksperymentalnie przez zamknięcie gazu wewnątrz cylindra wyposażonego w ruchomy tłok, jak pokazano na rysunkach 2 i 3. Na tłoku umieszcza się ciężarek o masie M skierowany w dół, podczas gdy gaz wywiera siła skierowana w górę dzięki ciśnieniu P wytwarzanemu na tłoku.

Ponieważ tłok może się swobodnie poruszać, objętość, jaką zajmuje gaz, może się zmieniać bez problemu, ale ciśnienie pozostaje stałe. Dodanie ciśnienia atmosferycznego P.bankomat, która również wywiera siłę skierowaną w dół, mamy:
Mg - P.A + Pbankomat . A = stała
Dlatego: P = (Mg / A) + Pbankomat nie zmienia się, chyba że M, a tym samym waga, są modyfikowane. Dodając ciepło do butli, gaz rozszerza się zwiększając swoją objętość lub kurczy się podczas pobierania ciepła..
Procesy izobaryczne w gazie idealnym
Równanie stanu gazu doskonałego wiąże ważne zmienne: ciśnienie P, objętość V i temperaturę T:
P.V = n .R.T
Tutaj n oznacza liczbę moli, a R jest idealną stałą gazu (obowiązującą dla wszystkich gazów), którą oblicza się przez pomnożenie stałej Boltzmanna przez liczbę Avogadro, co daje:
R = 8,31 J / mol K
Gdy ciśnienie jest stałe, równanie stanu można zapisać jako:
V / T = nR / P
Ale nR / P jest stałe, ponieważ n, R i P są. Kiedy więc system przechodzi ze stanu 1 do stanu 2, powstaje następująca proporcja, znana również jako prawo Karola:
V1/ T1 = Vdwa/ Tdwa
Zastępowanie w W = PΔV, pracę wykonaną w celu przejścia ze stanu 1 do stanu 2 uzyskuje się, pod względem stałych i zmian temperatury, łatwą do zmierzenia termometrem:
W1 → 2 = nR (T.dwa - T1) = nR.ΔT
Z drugiej strony, pierwsza zasada termodynamiki mówi, że:
∆U = Q - W
Oznacza to, że dodanie określonej ilości ciepła Q do gazu zwiększa energię wewnętrzną ∆U i zwiększa wibracje jego cząsteczek. W ten sposób gaz rozszerza się i działa, poruszając tłokiem, jak powiedzieliśmy wcześniej..
W jednoatomowym gazie idealnym i zmienność energii wewnętrznej ∆U, która obejmuje zarówno energię kinetyczną, jak i energię potencjalną jego cząsteczek, wynosi:
∆U = (3/2)nR ΔT
Na koniec łączymy otrzymane wyrażenia w jedno:
Q = ∆U + W = (3/2)nR ΔT + nR∆T = (5/2) nR ΔT
Alternatywnie Q można przepisać pod względem masy m, różnicy temperatur i nowej stałej o nazwie ciepło właściwe gazu przy stałym ciśnieniu, w skrócie cp, których jednostkami są J / mol K:
Q = m cp ∆T
Przykłady
Nie wszystkie procesy izobaryczne są przeprowadzane w zamkniętych pojemnikach. W rzeczywistości niezliczone wszelkiego rodzaju procesy termodynamiczne zachodzą pod ciśnieniem atmosferycznym, więc procesy izobaryczne są z natury bardzo częste. Obejmuje to fizyczne i chemiczne zmiany powierzchni ziemi, reakcje chemiczne w naczyniach otwartych do atmosfery i wiele więcej..
Aby procesy izobaryczne zachodziły w systemach zamkniętych, ich granice muszą być wystarczająco elastyczne, aby umożliwić zmiany objętości bez zmiany ciśnienia.
Tak stało się w eksperymencie z tłokiem, który poruszał się łatwo, gdy gaz rozszerzał się. To samo dzieje się z zamknięciem gazu w balonie imprezowym lub balonie na ogrzane powietrze.
Tutaj mamy kilka przykładów procesów izobarycznych:
Zagotuj wodę i gotuj
Gotowanie wody na herbatę lub gotowanie sosów w otwartych pojemnikach to dobre przykłady procesów izobarycznych, ponieważ wszystkie zachodzą pod ciśnieniem atmosferycznym..
Gdy woda jest podgrzewana, temperatura i objętość wzrastają, a jeśli dalej jest dodawane ciepło, ostatecznie osiąga się temperaturę wrzenia, w której następuje przemiana fazowa wody z ciekłej w parę wodną. W takim przypadku temperatura również pozostaje stała i wynosi 100ºC..
Zamrozić wodę
Z drugiej strony zamarzanie wody jest również procesem izobarycznym, niezależnie od tego, czy zachodzi w jeziorze zimą, czy w domowej lodówce..
Ogrzewanie balonu wypełnionego powietrzem na słońcu
Innym przykładem procesu izobarycznego jest zmiana objętości balonu napełnionego powietrzem, gdy jest on wystawiony na działanie słońca. Po pierwsze rano, gdy jeszcze nie jest bardzo gorąco, balon ma określoną objętość..
W miarę upływu czasu i wzrostu temperatury balon również się nagrzewa, zwiększając swoją objętość, a wszystko to przy stałym ciśnieniu. Materiał balonu jest dobrym przykładem obramowania, które jest na tyle elastyczne, że powietrze wewnątrz balonu po podgrzaniu rozszerza się bez zmiany ciśnienia.
Doświadczenie można również przeprowadzić regulując nienapompowany balonik w dziobku szklanej butelki wypełnionej jedną trzecią wody, która jest podgrzewana w kąpieli wodnej. Po podgrzaniu wody balon natychmiast się napełnia, ale należy uważać, aby nie nagrzać się zbyt mocno, aby nie wybuchnąć..
Balon aerostatyczny
Jest to pływający statek bez napędu, który wykorzystuje prądy powietrza do transportu ludzi i przedmiotów. Balon jest zwykle wypełniony gorącym powietrzem, które będąc zimniejsze niż otaczające powietrze, unosi się i rozszerza, powodując uniesienie balonu..
Chociaż prądy powietrza kierują balonem, ma on palniki, które są aktywowane w celu podgrzania gazu, gdy pożądane jest wzniesienie lub utrzymanie wysokości, i wyłączają się podczas opadania lub lądowania. Wszystko to dzieje się pod ciśnieniem atmosferycznym, założonym jako stałe na pewnej wysokości niedaleko powierzchni..

Kotły
W kotłach powstaje para wodna poprzez podgrzewanie wody i utrzymywanie stałego ciśnienia. Następnie para ta spełnia użyteczną funkcję, na przykład wytwarza energię elektryczną w elektrowniach termoelektrycznych lub uruchamia inne mechanizmy, takie jak lokomotywy i pompy wodne..
Rozwiązane ćwiczenia
Ćwiczenie 1
Jest 40 litrów gazu o temperaturze 27 ºC. Znajdź przyrost objętości przy dodawaniu ciepła izobarycznie, aż do osiągnięcia 100 ° C.
Rozwiązanie
Do określenia ostatecznej objętości używane jest prawo Karola, ale Uwaga: temperatury należy wyrażać w kelwinach, po prostu dodając do każdej z nich 273 K:
27 ° C = 27 + 273 K = 300 K.
100 ° C = 100 + 273 K = 373 K.
Z:
V1/ T1 = Vdwa/ Tdwa ⇒ Vdwa = Tdwa(V1/ T1) = 373 ºC (40 l / 300 K) = 49,7 l
Wreszcie wzrost głośności wynosi Vdwa - V1 = 49,7 l - 40 l = 9,7 l.
Ćwiczenie 2
Dostarczane 5,00 x 103 J energii do gazu doskonałego do wykonania 2,00 x 103 J. pracuje nad swoim środowiskiem w procesie izobarycznym. Należy znaleźć:
a) Zmiana energii wewnętrznej gazu.
b) Zmiana objętości, jeśli teraz energia wewnętrzna zmniejszy się o 4,50 x 103 J i 7,50 x 10 są wyrzucane3 J układu, biorąc pod uwagę stałe ciśnienie 1,01 x 105 Rocznie.
Rozwiązanie
Używany ∆U = Q - W a wartości podane w oświadczeniu zastępuje się: Q = 5,00 x 103 J i W = 2,00 x 103 JOT:
=5,00 x 103 J - 2,00 x 103 J = 3,00 x 103 jot
Dlatego energia wewnętrzna gazu wzrasta o 3,00 x 103 jot.
Rozwiązanie b
Zmiana głośności znajduje się w wykonanej pracy: W = P∆V:
∆U = Q - W = Q - P∆V
Stwierdzono, że energia wewnętrzna maleje, a zatem: ∆U= -4,50 x 103 J. Mówi nam również, że pewna ilość ciepła jest wydalana: Q = -7,50 x 103 J. W obu przypadkach znak ujemny reprezentuje spadek i stratę, więc:
-4,50 x 103 J = -7,50 x 103 J - P∆V
Gdzie P = 1,01 x 105 Pa. Ponieważ wszystkie jednostki są w układzie międzynarodowym, przystępujemy do rozwiązania zmiany objętości:
∆V = (-4,50 x 103 J +7,50 x 103 J) / (- 1,01 x 105 Rocznie) = -2,97 x 10-dwa m3
Ponieważ zmiana objętości jest ujemna, oznacza to, że objętość spadła, to znaczy system się skurczył.
Bibliografia
- Byjou's. Proces izobaryczny. Odzyskany z: byjus.com.
- Cengel, rok 2012. Termodynamika. 7th Edition. Mcgraw hill.
- Przetwórz xyz. Dowiedz się więcej o procesie izobarycznym. Odzyskany z: 10proceso.xyz.
- Serway, R., Vulle, C. 2011. Podstawy fizyki. 9th Ed. Cengage Learning.
- Wikipedia. Przepisy dotyczące gazu. Odzyskane z: es.wikipedia.org.



Jeszcze bez komentarzy