
Właściwości koligatywne (ze wzorami)
Plik własność koligatywna to dowolna właściwość substancji, która zależy lub zmienia się w zależności od liczby obecnych w niej cząstek (w postaci cząsteczek lub atomów), niezależnie od charakteru tych cząstek.
Innymi słowy, można je również wyjaśnić jako właściwości roztworów, które zależą od relacji między liczbą cząstek substancji rozpuszczonej a liczbą cząstek rozpuszczalnika. Koncepcja ta została wprowadzona w 1891 roku przez niemieckiego chemika Wilhelma Ostwalda, który podzielił właściwości substancji rozpuszczonej na trzy kategorie.

Kategorie te głosiły, że właściwości koligatywne zależą wyłącznie od stężenia i temperatury substancji rozpuszczonej, a nie od natury jej cząstek..
Ponadto właściwości addytywne, takie jak masa, zależały od składu substancji rozpuszczonej, a właściwości konstytucyjne zależały bardziej od struktury cząsteczkowej substancji rozpuszczonej..
Indeks artykułów
- 1 Właściwości koligatywne
- 1.1 Spadek prężności par
- 1.2 Podwyższenie temperatury wrzenia
- 1.3 Obniżenie temperatury zamarzania
- 1.4 Ciśnienie osmotyczne
- 2 Odnośniki
Właściwości koligatywne
Właściwości koligatywne są badane głównie dla rozcieńczonych roztworów (ze względu na ich prawie idealne zachowanie) i są następujące:
Spadek prężności par
Można powiedzieć, że prężność pary cieczy jest ciśnieniem równowagowym cząsteczek pary, z którymi styka się ta ciecz.
Podobnie związek tych ciśnień jest wyjaśniony prawem Raoulta, które wyraża, że ciśnienie cząstkowe składnika jest równe iloczynowi ułamka molowego składnika przez prężność pary składnika w stanie czystym:
P.DO = XDO . PºDO
W tym wyrażeniu:
P.DO = Częściowa prężność par składnika A w mieszaninie.
XDO = Ułamek molowy składnika A.
PºDO= Prężność par czystego składnika A..
W przypadku spadku prężności par rozpuszczalnika ma to miejsce, gdy dodaje się do niego nielotną substancję rozpuszczoną w celu utworzenia roztworu. Jak wiadomo iz definicji nielotna substancja nie ma tendencji do parowania.
Z tego powodu im więcej tej substancji rozpuszczonej dodaje się do lotnego rozpuszczalnika, tym niższe będzie ciśnienie pary i tym mniej rozpuszczalnika może uciec, aby stać się stanem gazowym..
Tak więc, gdy rozpuszczalnik wyparuje w sposób naturalny lub wymuszony, pewna ilość rozpuszczalnika ostatecznie pozostanie bez odparowania wraz z nielotną substancją rozpuszczoną..
Zjawisko to można lepiej wytłumaczyć pojęciem entropii: kiedy cząsteczki przechodzą z fazy ciekłej do fazy gazowej, entropia układu wzrasta..
Oznacza to, że entropia tej fazy gazowej zawsze będzie większa niż stanu ciekłego, ponieważ cząsteczki gazu zajmują większą objętość..
Następnie, jeśli entropia stanu ciekłego wzrasta przez rozcieńczenie, mimo że jest połączona z substancją rozpuszczoną, różnica między dwoma układami maleje. Z tego powodu zmniejszenie entropii zmniejsza również ciśnienie pary..
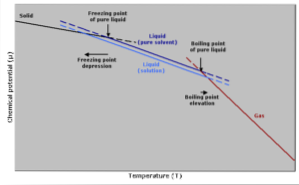
Wzrost temperatury wrzenia
Temperatura wrzenia to temperatura, w której istnieje równowaga między fazą ciekłą i gazową. W tym momencie liczba cząsteczek gazu przechodzących w stan ciekły (skraplających się) jest równa liczbie cząsteczek cieczy parujących do gazu..
Dodanie substancji rozpuszczonej powoduje rozcieńczenie stężenia cząsteczek cieczy, co powoduje zmniejszenie szybkości parowania. Powoduje to zmianę temperatury wrzenia, aby skompensować zmianę stężenia rozpuszczalnika..
Innymi prostszymi słowami, temperatura wrzenia roztworu jest wyższa niż rozpuszczalnika w stanie czystym. Wyraża się to za pomocą wyrażenia matematycznego pokazanego poniżej:
ΔTb = ja. K.b . m
W tym wyrażeniu:
ΔTb = Tb (rozwiązanie) - Tb (rozpuszczalnik) = zmiana temperatury wrzenia.
i = współczynnik van't Hoffa.
K.b = Stała wrzenia rozpuszczalnika (0,512 ºC / mol dla wody).
m = Molalność (mol / kg).
Obniżenie temperatury krzepnięcia
Temperatura zamarzania czystego rozpuszczalnika spada, gdy dodaje się pewną ilość substancji rozpuszczonej, ponieważ wpływa na nią to samo zjawisko, w którym spada prężność pary..
Dzieje się tak, ponieważ zmniejszając prężność par rozpuszczalnika poprzez rozcieńczanie substancji rozpuszczonej, wymagana będzie niższa temperatura, aby spowodować jej zamarznięcie..
Aby wyjaśnić to zjawisko, można również wziąć pod uwagę naturę procesu zamrażania: aby ciecz zamarzła, musi osiągnąć uporządkowany stan, w którym ostatecznie tworzy kryształy..
Jeśli w cieczy znajdują się zanieczyszczenia w postaci substancji rozpuszczonych, ciecz będzie mniej uporządkowana. Z tego powodu roztwór będzie miał większe trudności z zamarzaniem niż rozpuszczalnik bez zanieczyszczeń..
Zmniejszenie to jest wyrażone jako:
ΔTfa = -i. K.fa . m
W powyższym wyrażeniu:
ΔTfa = Tfa (rozwiązanie) - Tfa (rozpuszczalnik) = wahania temperatury krzepnięcia.
i = współczynnik van't Hoffa.
K.fa = Stała krzepnięcia rozpuszczalnika (1,86 ° C kg / mol dla wody).
m = Molalność (mol / kg).
Ciśnienie osmotyczne
Proces znany jako osmoza to tendencja rozpuszczalnika do przechodzenia przez półprzepuszczalną membranę z jednego roztworu do drugiego (lub od czystego rozpuszczalnika do roztworu).
Ta membrana stanowi barierę, przez którą niektóre substancje mogą przejść, a inne nie, jak w przypadku półprzepuszczalnych błon w ścianach komórkowych komórek zwierzęcych i roślinnych..
Ciśnienie osmotyczne jest następnie definiowane jako minimalne ciśnienie, które należy przyłożyć do roztworu, aby zatrzymać przenikanie jego czystego rozpuszczalnika przez półprzepuszczalną membranę..
Jest również znany jako miara skłonności roztworu do przyjmowania czystego rozpuszczalnika w wyniku efektu osmozy. Ta właściwość jest koligatywna, ponieważ zależy od stężenia substancji rozpuszczonej w roztworze, które wyraża się jako wyrażenie matematyczne:
Π. V = n. R. T lub też π = M. R. T
W tych wyrażeniach:
n = liczba moli cząstek w roztworze.
R = uniwersalna stała gazowa (8,314472 J.K-1 . kret-1).
T = temperatura w kelwinach.
M = Molarność.
Bibliografia
- Wikipedia. (s.f.). Właściwości koligatywne. Pobrane z en.wikipedia.org
- PNE. (s.f.). Właściwości koligatywne. Odzyskany z opentextbc.ca
- Bosma, W. B. (s.f.). Właściwości koligatywne. Pobrane z chemistryexplained.com
- Sparknotes. (s.f.). Właściwości koligatywne. Odzyskany z sparknotes.com
- University, F. S. (s.f.). Właściwości koligatywne. Pobrane z chem.fsu.edu



Jeszcze bez komentarzy