
Rodzaje i funkcje proteolizy

Plik proteoliza o degradacja białek to proces, w którym białka komórki mogą ulec całkowitej degradacji (aż do ich składowych aminokwasów) lub częściowej (wytworzenie peptydów). Oznacza to, że polega na hydrolizie jednego lub więcej wiązań peptydowych, które utrzymują razem ich aminokwasy..
Proces ten może zachodzić dzięki udziałowi innych białek o aktywności enzymatycznej, w których miejscach aktywnych zachodzi hydroliza wiązań. Może również wystąpić metodami nieenzymatycznymi, takimi jak działanie ciepła lub substancji o skrajnym pH (bardzo kwaśnym lub bardzo zasadowym).
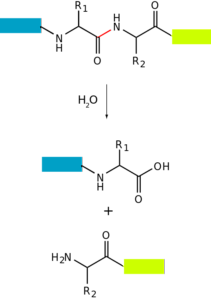
Degradacja białek zachodzi u bakterii, zwierząt i roślin, ale jest szczególnie powszechna u zwierząt, zwłaszcza na poziomie układu pokarmowego, ponieważ od tego zależy trawienie i wchłanianie jelitowe białek wchłanianych w pożywienie..
Ponadto proteoliza ma ogromne znaczenie dla utrzymania funkcjonalnego i regulacji wielu procesów komórkowych, a także ma do czynienia z eliminacją tych białek, które powodują błędy w translacji, fałdowaniu, pakowaniu, imporcie, działaniu itp..
Należy podkreślić, że jest to nieodwracalny, wysoce skuteczny proces, który działa również w „regulacji regulatorów”, ponieważ eliminuje nie tylko te białka, które mają „bezpośrednią” aktywność biologiczną, ale także te, które regulują inne białka lub ekspresję odpowiednich genów.
Indeks artykułów
- 1 Rodzaje proteolizy
- 1.1 Proteoliza ubikwitynacji
- 1.2 Proteoliza przez autofagię
- 1.3 Nieenzymatyczna proteoliza
- 2 Funkcje
- 2.1 W układzie odpornościowym
- 2.2 Inne funkcje
- 2.3 W roślinach
- 3 Odnośniki
Rodzaje proteolizy
Wewnętrzne białka komórki mogą ulegać degradacji losowo lub wybiórczo lub co prawda w sposób kontrolowany lub nie. Z kolei, jak wspomniano wcześniej, proces ten może zachodzić za pomocą specjalnych enzymów lub z powodu określonych warunków środowiskowych, takich jak kwaśne i / lub zasadowe pH..
Należy wspomnieć, że każde prawidłowo przetłumaczone, pofałdowane lub upakowane białko ukrywa jedną lub więcej sekwencji sygnałowych degradacji, które są „tajemnicze” i które mogą być eksponowane, gdy białko jest strukturalnie zaburzone przez temperaturę, pH itp..
Proteoliza ubikwitynacji
Ubikwitynacja (układ ubikwityna-proteasom) to system, w którym białka mogą być selektywnie hydrolizowane po ich specyficznej degradacji, proces, który może zachodzić zarówno w cytozolu, jak iw jądrze komórkowym.
System ten ma zdolność rozpoznawania i niszczenia znakowanych białek w jądrze i cytozolu, a także degradacji białek, które nie fałdują się prawidłowo podczas ich translokacji z cytozolu do retikulum endoplazmatycznego..
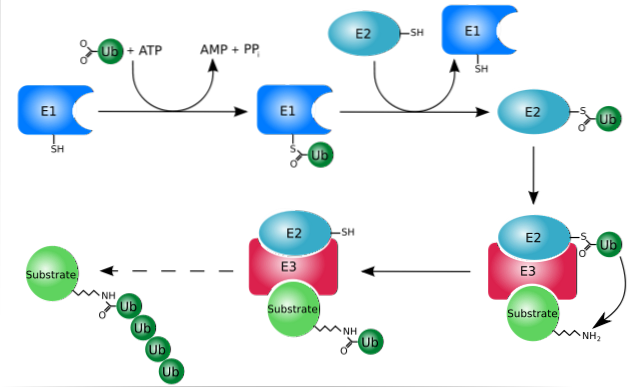
Działa głównie poprzez dodanie lub sprzężenie „docelowych” białek z małym białkiem lub peptydem składającym się z 76 reszt aminokwasowych, lepiej znanego jako ubikwityna. Te „naznaczone” białka przez ubikwitynację są rozkładane na małe fragmenty przez proteasom 26S, proteazę wielopodjednostkową..
Proteoliza przez autofagię
Autofagia jest również uważana przez niektórych autorów za formę proteolizy, z tą różnicą, że występuje w zamkniętym przedziale błoniastym, który jest skierowany do lizosomów (w komórkach zwierzęcych), gdzie zawarte w nich białka są degradowane przez proteazy lizosomalne.
Nieenzymatyczna proteoliza
Temperatura, pH, a nawet stężenie soli w pożywce może powodować hydrolizę wiązań peptydowych, które utrzymują razem aminokwasy różnych typów białek, co następuje przez destabilizację i przerwanie wiązań..
funkcje
Proteoliza pełni wiele funkcji w organizmach żywych. W szczególności ma to związek z obrotem białek, w wyniku którego niektóre specyficzne cząsteczki białka, które uległy translacji z jednego lub większej liczby rybosomów, są ostatecznie degradowane w różnym tempie..
Białka mają okres półtrwania, który waha się od kilku sekund do kilku miesięcy, a produkty ich degradacji, regulowanej lub nie, za pośrednictwem enzymów lub nie, są na ogół ponownie wykorzystywane do syntezy nowych białek, które prawdopodobnie spełniają różne funkcje..
Tak dzieje się z białkami spożywanymi z pożywieniem, które są rozkładane w przewodzie pokarmowym przez proteazy, w tym trypsynę i pepsynę; jak również w przypadku niektórych białek komórkowych, gdy komórkom brakuje pożywienia, aby przeżyć.
Wewnątrzkomórkowe systemy proteolityczne wykrywają i eliminują „nieprawidłowe” białka, które są potencjalnie toksyczne dla komórek, ponieważ mogą oddziaływać z „fizjologicznie niewłaściwymi” ligandami, a ponadto wytwarzają agregaty, które powodują mechaniczne i fizyczne utrudnienia w normalnych procesach komórkowych..
Nagromadzenie nieprawidłowych białek wewnątrz komórki, albo z powodu defektów w wewnętrznym układzie proteolitycznym, albo z innych powodów, jest tym, co wielu naukowców uważa za jedną z głównych przyczyn starzenia się organizmów wielokomórkowych..
W układzie odpornościowym
Częściowa proteoliza wielu białek z egzogennych lub obcych źródeł, takich jak na przykład atakujące mikroorganizmy, jest podstawowym procesem dla układu odpowiedzi immunologicznej, ponieważ limfocyty T rozpoznają krótkie fragmenty, produkt proteolizy (peptydy), które są im prezentowane. w połączeniu z zestawem białek powierzchniowych.
Te peptydy mogą pochodzić z układu ubikwitynacji, procesów autofagicznych lub niekontrolowanych zdarzeń proteolizy..
Inne funkcje
Inną funkcją ograniczonej lub częściowej proteolizy jest modyfikacja nowo powstałych białek, które funkcjonują jako „preparat” dla ich funkcji wewnątrz- lub zewnątrzkomórkowych. Dotyczy to na przykład niektórych hormonów i białek zaangażowanych w różne procesy metaboliczne..
Programowana śmierć komórki (apoptoza) zależy również w dużym stopniu od ograniczonej lub częściowej „specyficznej miejscowo” proteolizy białek wewnątrzkomórkowych, w której pośredniczy kaskada specyficznych proteaz zwanych kaspazami..
Zewnątrzkomórkowe układy regulacyjne zależą również od proteolizy specyficznej dla danego miejsca, a najbardziej znanym przykładem jest krzepnięcie krwi..
Ogólna lub całkowita proteoliza spełnia również podstawowe funkcje w selektywnej degradacji tych białek, których stężenie musi być dokładnie kontrolowane w zależności od fizjologii, metabolizmu lub rozwoju komórek..
W roślinach
Rośliny wykorzystują również procesy proteolityczne do kontrolowania wielu ich fizjologicznych i rozwojowych aspektów. Działa np. W utrzymaniu warunków wewnątrzkomórkowych oraz w mechanizmach reakcji na warunki stresowe, takie jak między innymi susza, zasolenie, temperatura..
Podobnie jak u zwierząt, proteoliza w roślinach współdziała w aktywacji i dojrzewaniu zymogenów (nieaktywnych białek), kontroluje metabolizm, homeostazę, procesy zaprogramowanej śmierci komórek, rozwój tkanek i narządów itp. W tych organizmach szlak proteolizy przez ubikwitynację jest jednym z najważniejszych.
Bibliografia
- Alberts, B., Bray, D., Hopkin, K., Johnson, A. D., Lewis, J., Raff, M.,… & Walter, P. (2013). Niezbędna biologia komórki. Nauka o Garland.
- Maurizi, M. R. (1992). Proteazy i degradacja białek w Escherichia coli. Experientia, 48 (2), 178–201.
- Varshavsky, A. (2005). Regulowana degradacja białek. Trendy w naukach biochemicznych, 30 (6), 283-286.
- Vierstra, R. D. (1996). Proteoliza u roślin: mechanizmy i funkcje. In Post-Transcriptional Control of Gene Expression in Plants (str. 275-302). Springer, Dordrecht.
- Wolf, D. H., & Menssen, R. (2018). Mechanizmy regulacji komórki - proteoliza, wielka niespodzianka. Listy FEBS, 592 (15), 2515-2524.



Jeszcze bez komentarzy