
Jakie jest ciepło reakcji?

Plik ciepło reakcji lub Entalpia reakcji (ΔH) to zmiana entalpii reakcji chemicznej zachodzącej przy stałym ciśnieniu. Jest to termodynamiczna jednostka miary przydatna do obliczania ilości energii na mol, która jest uwalniana lub wytwarzana w reakcji.
Ponieważ entalpia jest wyprowadzana z ciśnienia, objętości i energii wewnętrznej, z których wszystkie są funkcjami stanu, entalpia jest również funkcją stanu..
ΔH, czyli zmiana entalpii pojawiła się jako jednostka miary mająca na celu obliczenie zmiany energii układu, gdy znalezienie ΔU lub zmiana energii wewnętrznej układu stało się zbyt trudne, jednocześnie mierząc ilość wymienionego ciepła i pracy.
Przy stałym ciśnieniu zmiana entalpii równa się ciepłu i można ją zmierzyć jako ΔH = q.
Notacja ΔHº lub ΔHºr następnie pojawia się, aby wyjaśnić dokładną temperaturę i ciśnienie ciepła reakcji ΔH.
Standardowa entalpia reakcji jest symbolizowana przez ΔHº lub ΔHºrxn i może przyjmować zarówno wartości dodatnie, jak i ujemne. Jednostki ΔHº to kilodżule na mol lub kj / mol.
Poprzednia koncepcja zrozumienia ciepła reakcji: różnice między ΔH i ΔHºr.
Δ = oznacza zmianę entalpii (entalpia produktów minus entalpia reagentów).
Dodatnia wartość wskazuje, że produkty mają wyższą entalpię lub że jest to reakcja endotermiczna (wymagane jest ciepło).
Wartość ujemna wskazuje, że reagenty mają wyższą entalpię lub że jest to reakcja egzotermiczna (wytwarzane jest ciepło).
º = oznacza, że reakcja jest standardową zmianą entalpii i zachodzi przy zadanym ciśnieniu / temperaturze.
r = oznacza, że ta zmiana jest entalpią reakcji.
Stan standardowy: stanem stałym ciała stałego lub cieczy jest czysta substancja pod ciśnieniem 1 bara lub o tej samej 1 atmosferze (105 Pa) i temperaturze 25 ° C lub o takiej samej wartości 298 K.
ΔHºr jest standardowym ciepłem reakcji lub standardową entalpią reakcji, a jako ΔH mierzy również entalpię reakcji. Jednak ΔHºrxn zachodzi w „standardowych” warunkach, co oznacza, że reakcja przebiega w 25º C i 1 atm..
Zaletą pomiaru ΔH w warunkach standardowych jest możliwość powiązania jednej wartości ΔHº z inną, ponieważ występują one w tych samych warunkach.
Ciepło formowania
Standardowe ciepło tworzenia, ΔHfaº produktu chemicznego to ilość ciepła zaabsorbowanego lub uwolnionego podczas tworzenia 1 mola tej substancji chemicznej w temperaturze 25 stopni Celsjusza i 1 bara jej pierwiastków w ich stanach standardowych.
Element jest w stanie standardowym, jeśli jest w najbardziej stabilnej postaci i stanie fizycznym (stałym, ciekłym lub gazowym) w temperaturze 25 stopni Celsjusza i 1 bar.
Na przykład standardowe ciepło tworzenia się dwutlenku węgla obejmuje tlen i węgiel jako reagenty..
Tlen jest bardziej stabilny jako cząsteczki gazu O.dwa, podczas gdy węgiel jest bardziej stabilny niż stały grafit. (Grafit jest bardziej stabilny niż diament w standardowych warunkach).
Aby wyrazić definicję w inny sposób, standardowe ciepło tworzenia jest specjalnym typem standardowego ciepła reakcji..
Reakcja polega na utworzeniu 1 mola substancji chemicznej z jej pierwiastków w ich standardowych stanach w standardowych warunkach.
Standardowe ciepło formacji jest również nazywane standardową entalpią formacji (chociaż w rzeczywistości jest to zmiana entalpii).
Z definicji powstanie samego pierwiastka nie spowodowałoby żadnej zmiany entalpii, więc standardowe ciepło reakcji dla wszystkich pierwiastków wynosi zero (Cai, 2014).
Obliczanie entalpii reakcji
1- Obliczenia eksperymentalne
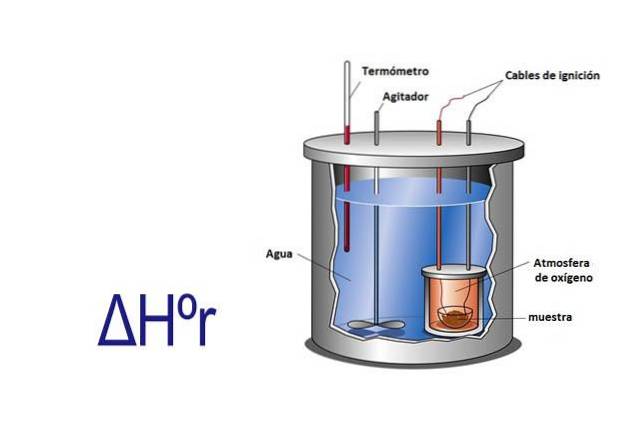
Entalpię można zmierzyć eksperymentalnie za pomocą kalorymetru. Kalorymetr to przyrząd, w którym próbka jest poddawana reakcji przez kable elektryczne, które zapewniają energię aktywacji. Próbka znajduje się w pojemniku otoczonym wodą, która jest stale mieszana.
Mierząc ze zmianą temperatury, która zachodzi, gdy próbka reaguje, i znając ciepło właściwe wody i jej masę, ciepło uwolnione lub pochłonięte przez reakcję oblicza się za pomocą równania q = Cesp x m x ΔT.
W tym równaniu q to ciepło, Cesp to ciepło właściwe w tym przypadku wody, które jest równe 1 kalorii na gram, m to masa wody, a ΔT to zmiana temperatury.
Kalorymetr to izolowany system o stałym ciśnieniu, a więc ΔHr= q
2- Obliczenia teoretyczne
Zmiana entalpii nie zależy od konkretnej ścieżki reakcji, ale tylko od globalnego poziomu energii produktów i reagentów. Entalpia jest funkcją stanu i jako taka jest addytywna.
Aby obliczyć standardową entalpię reakcji, możemy dodać standardowe entalpie tworzenia reagentów i odjąć je od sumy standardowych entalpii tworzenia produktów (Boundless, S.F.). Mówiąc matematycznie, daje nam to:
ΔHr° = Σ ΔHfaº (produkty) - Σ ΔHfaº (reagenty).
Entalpie reakcji są zwykle obliczane na podstawie entalpii tworzenia reagentów w normalnych warunkach (ciśnienie 1 bar i temperatura 25 stopni Celsjusza).
Aby wyjaśnić tę zasadę termodynamiki, obliczymy entalpię reakcji spalania metanu (CH4) wg wzoru:
CH4 (g) + 2Odwa (g) → COdwa (g) + 2HdwaO (g)
Aby obliczyć standardową entalpię reakcji, musimy znaleźć standardowe entalpie tworzenia dla każdego z reagentów i produktów biorących udział w reakcji..
Można je zwykle znaleźć w załączniku lub w różnych tabelach online. Dane, których potrzebujemy do tej reakcji, to:
H.faº CH4 (g) = -75 kJoul / mol.
H.faº Odwa (g) = 0 kJoul / mol.
H.faº COdwa (g) = -394 kjoul / mol.
H.faº HdwaO (g) = -284 kjoul / mol.
Zauważ, że ponieważ jest w stanie standardowym, standardowa entalpia tworzenia tlenu gazowego wynosi 0 kJ / mol.
Tutaj podsumowujemy nasze standardowe entalpie formacji. Zauważ, że ponieważ jednostki są w kJ / mol, musimy pomnożyć przez współczynniki stechiometryczne w zbilansowanym równaniu reakcji (Leaf Group Ltd, S.F.).
Σ ΔHfaº (produkty) = ΔHfaº COdwa +2 ΔHfaº HdwaLUB
Σ ΔHfaº (produkty) = -1 (394 kJoul / mol) -2 (284 kJoul / mol) = -962 kjoul / mol
Σ ΔHfaº (reagenty) = ΔHfaº CH4 + ΔHfaº Odwa
Σ ΔHfaº (reagenty) = -75 kJoul / mol + 2 (0 kJoul / mol) = -75 kjoul / mol
Teraz możemy znaleźć standardową entalpię reakcji:
ΔHr° = Σ ΔHfaº (produkty) - Σ ΔHfaº (reagenty) = (- 962) - (- 75) =
ΔHr° = - 887 kJ / mol.
Bibliografia
- Anne Marie Helmenstine. (2014, 11 czerwca). Definicja entalpii reakcji. Odzyskany z thinkco: thinkco.com.
- (S.F.). Standardowa entalpia reakcji. Odzyskany z boundless: boundless.com.
- Cai, E. (2014, 11 marca). standardowe ciepło formowania. Odzyskane od chemicalstatistician: chemicalstatistician.wordpress.com.
- Clark, J. (2013, maj). Różne definicje zmiany entalpii. Odzyskany z chemguide.co.uk: chemguide.co.uk.
- Jonathan Nguyen, G. L. (9 lutego 2017). Standardowa entalpia formacji. Odzyskany z chem.libretexts.org: chem.libretexts.org.
- Leaf Group Ltd. (S.F.). Jak obliczyć entalpie reakcji. Odzyskany z sciencing: sciencing.com.
- Rachel Martin, E.Y. (7 maja 2014). Ciepło reakcji. Odzyskany z chem.libretexts.org: chem.libretexts.org.


Jeszcze bez komentarzy