
Co to jest notacja widmowa?
Plik notacja widmowa to rozmieszczenie elektronów na poziomach energii wokół jądra atomu. Zgodnie ze starym modelem atomowym Bohra elektrony zajmują różne poziomy na orbitach wokół jądra, od pierwszej powłoki najbliżej jądra, K, do siódmej powłoki Q, która jest najbardziej oddalona od jądra..
Jeśli chodzi o bardziej wyrafinowany model mechaniki kwantowej, powłoki K-Q są podzielone na zestaw orbitali, z których każdy może być zajęty przez nie więcej niż jedną parę elektronów..

Zwykle konfiguracja elektronów jest używana do opisania orbitali atomu w jego stanie podstawowym, ale może być również używana do reprezentowania atomu, który zjonizował się do kationu lub anionu, kompensując utratę lub zysk elektronów w ich odpowiednich orbitali ..
Wiele właściwości fizycznych i chemicznych pierwiastków można skorelować z ich unikalnymi konfiguracjami elektronicznymi. Elektrony walencyjne, elektrony w najbardziej zewnętrznej powłoce, są decydującym czynnikiem dla wyjątkowej chemii pierwiastka..
Kiedy elektrony w najbardziej zewnętrznej powłoce atomu otrzymają jakąś energię, przemieszczają się do warstw o wyższej energii. W ten sposób elektron w powłoce K zostanie przeniesiony do powłoki L będącej w stanie wyższej energii.
Kiedy elektron powraca do stanu podstawowego, uwalnia zaabsorbowaną energię, emitując widmo elektromagnetyczne (światło). Ponieważ każdy atom ma określoną konfigurację elektronową, będzie miał również określone widmo, które będzie nazywane widmem absorpcyjnym (lub emisyjnym)..
Z tego powodu termin notacja widmowa jest używany w odniesieniu do konfiguracji elektronów.
Jak określić notację spektralną: liczby kwantowe
W sumie cztery liczby kwantowe są używane do pełnego opisania ruchu i trajektorii każdego elektronu w atomie..
Połączenie wszystkich liczb kwantowych wszystkich elektronów w atomie jest opisane funkcją falową, która spełnia równanie Schrödingera. Każdy elektron w atomie ma unikalny zestaw liczb kwantowych.
Zgodnie z zasadą wykluczenia Pauliego dwa elektrony nie mogą mieć tej samej kombinacji czterech liczb kwantowych.
Liczby kwantowe są ważne, ponieważ można je wykorzystać do określenia konfiguracji elektronowej atomu i prawdopodobnej lokalizacji elektronów w atomie..
Liczby kwantowe są również używane do określania innych cech atomów, takich jak energia jonizacji i promień atomowy..
Liczby kwantowe oznaczają określone powłoki, podpowłoki, orbitale i spiny elektronów.
Oznacza to, że w pełni opisują charakterystykę elektronu w atomie, to znaczy opisują każde unikalne rozwiązanie równania Schrödingera lub funkcji falowej elektronów w atomie..
W sumie są cztery liczby kwantowe: główna liczba kwantowa (n), liczba kwantowa orbitalnego momentu pędu (l), magnetyczna liczba kwantowa (ml) i liczba kwantowa spinu elektronu (ms).
Główna liczba kwantowa nn opisuje energię elektronu i najbardziej prawdopodobną odległość elektronu od jądra. Innymi słowy, odnosi się do rozmiaru orbitalu i poziomu energii, na którym umieszczony jest elektron..
Liczba podpowłok, czyli ll, opisuje kształt orbity. Można go również użyć do określenia liczby węzłów kątowych.
Magnetyczna liczba kwantowa, ml, opisuje poziomy energii w podpowłoce, a ms oznacza spin elektronu, który może być w górę lub w dół..
Zasada Aufbau
Aufbau pochodzi od niemieckiego słowa „Aufbauen”, które oznacza „budować”. W istocie, pisząc konfiguracje elektronów, budujemy orbitale elektronów, gdy przechodzimy od jednego atomu do drugiego..
Kiedy piszemy konfigurację elektronową atomu, wypełnimy orbitale w kolejności rosnącej liczby atomowej.
Zasada Aufbau wywodzi się z zasady wykluczenia Pauliego, która mówi, że w atomie nie ma dwóch fermionów (np. Elektronów).
Mogą mieć ten sam zestaw liczb kwantowych, więc muszą „układać się” na wyższych poziomach energii. Sposób gromadzenia się elektronów jest kwestią konfiguracji elektronów.
Stabilne atomy mają tyle samo elektronów, ile protonów w jądrze. Elektrony gromadzą się wokół jądra w orbitali kwantowych zgodnie z czterema podstawowymi regułami zwanymi zasadą Aufbau..
- W atomie nie ma dwóch elektronów, które mają te same cztery liczby kwantowe n, l, m i s.
- Elektrony zajmą najpierw orbitale o najniższym poziomie energii.
- Elektrony zawsze będą wypełniać orbitale o tej samej liczbie spinowej. Kiedy orbitale będą pełne, zacznie się.
- Elektrony wypełnią orbitale sumą liczb kwantowych n i l. Orbitale o równych wartościach (n + l) zostaną najpierw wypełnione niższymi n wartościami.
Druga i czwarta zasada są w zasadzie takie same. Przykładem reguły czwartej byłyby orbitale 2p i 3s.
Orbital 2p to n = 2 i l = 2, a orbital 3s to n = 3 i l = 1. (N + l) = 4 w obu przypadkach, ale orbital 2p ma najniższą energię lub najniższą wartość n i będzie wypełnić przed warstwą 3s.
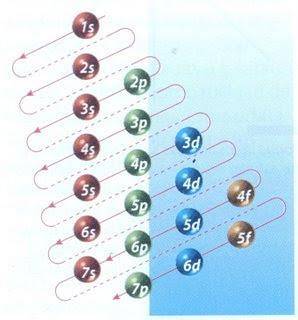
Na szczęście diagram Moellera pokazany na rysunku 2 może być użyty do wypełnienia elektronów. Wykres odczytuje się, wykonując przekątne od 1s.
Rysunek 2 przedstawia orbitale atomowe, a strzałki wskazują drogę naprzód.
Teraz, gdy wiadomo, że kolejność orbitali jest wypełniona, jedyne, co pozostało, to zapamiętanie rozmiaru każdego orbitalu.
Orbitale S mają 1 możliwą wartość ml do przechowywania 2 elektronów
Orbitale P mają 3 możliwe wartości ml pomieścić 6 elektronów
Orbitale D mają 5 możliwych wartości ml pomieścić 10 elektronów
Orbitale F mają 7 możliwych wartości ml do przechowywania 14 elektronów
To wszystko, co jest potrzebne do określenia konfiguracji elektronicznej stabilnego atomu pierwiastka..
Na przykład weźmy pierwiastek azotu. Azot ma siedem protonów, a zatem siedem elektronów. Pierwszy orbital do wypełnienia to orbital 1s. Orbital s ma dwa elektrony, więc zostało pięć elektronów.
Następny orbital to orbital 2s i zawiera kolejne dwa. Ostatnie trzy elektrony trafią na orbital 2p, który może pomieścić do sześciu elektronów.
Hund rządzi
W części Aufbau omówiono, w jaki sposób elektrony najpierw wypełniają orbitale o najniższej energii, a następnie przechodzą do orbitali o najwyższej energii dopiero po wypełnieniu orbitali o najniższej energii..
Z tą zasadą jest jednak problem. Z pewnością orbitale 1s muszą być wypełnione przed orbitalami 2s, ponieważ orbitale 1s mają niższą wartość n, a zatem mniejszą energię..
A trzy różne orbitale 2p? W jakiej kolejności należy je wypełniać? Odpowiedź na to pytanie dotyczy reguły Hunda.
Reguła Hunda mówi, że:
- Każdy orbital na poziomie podrzędnym jest zajmowany indywidualnie, zanim którykolwiek z orbitalów zostanie zajęty podwójnie.
- Wszystkie elektrony na indywidualnie zajętych orbitali mają ten sam spin (aby zmaksymalizować spin całkowity).
Kiedy elektrony są przypisane do orbitali, elektron najpierw stara się wypełnić wszystkie orbitale podobną energią (zwane również orbitali zdegenerowanymi), zanim połączy się z innym elektronem na półpełnym orbicie..
Atomy w stanach podstawowych mają zwykle jak najwięcej niesparowanych elektronów. Wizualizując ten proces, zastanów się, jak elektrony zachowują się tak samo, jak te same bieguny w magnesie, gdyby miały się zetknąć..
Kiedy ujemnie naładowane elektrony wypełniają orbitale, najpierw próbują oddalić się od siebie tak daleko, jak to możliwe, zanim będą musiały się sparować..
Bibliografia
- Anastasiya Kamenko, T.E. (24 marca 2017 r.). Liczby kwantowe. Odzyskany z chem.libretexts.org.
- Zasada Aufbau. (2015, 3 czerwca). Odzyskany z chem.libretexts.org.
- Konfiguracje elektronowe i właściwości atomów. (S.F.). Odzyskany z oneonta.edu.
- Encyclopædia Britannica. (2011, 7 września). Elektroniczna Konfiguracja. Odzyskany z britannica.com.
- Helmenstine, T. (7 marca 2017). Zasada Aufbau - struktura elektroniczna i zasada Aufbau. Odzyskany z thinkco.com.
- Zasady Hunda. (18 lipca 2015). Odzyskany z chem.libretexts.org.
- Notacja spektroskopowa. (S.F.). Odzyskany z bcs.whfreeman.com.



Jeszcze bez komentarzy