
Co to jest prototrof i jakie są jego zastosowania?
Plik prototrofy Są to organizmy lub komórki zdolne do wytwarzania aminokwasów potrzebnych do ich procesów życiowych. Termin ten jest ogólnie używany w odniesieniu do określonej substancji. Jest to przeciwieństwo terminu auksotrof.
Ten ostatni termin jest używany do zdefiniowania mikroorganizmu, który jest zdolny do wzrostu i namnażania się w pożywce hodowlanej tylko wtedy, gdy został do niego dodany określony składnik odżywczy. W przypadku prototrofa może się rozwijać bez tej substancji, ponieważ jest w stanie sama ją wytworzyć.
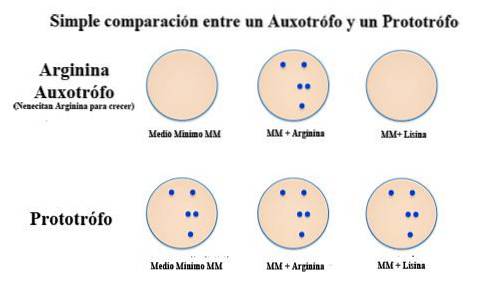
Na przykład organizm lub szczep, który nie może rosnąć bez lizyny, zostałby nazwany auksotroficzną lizyną. Z kolei prototroficzny szczep lizyny będzie rosnąć i rozmnażać się niezależnie od obecności lub braku lizyny w pożywce hodowlanej..
Zasadniczo szczep auksotroficzny utracił funkcjonalną ścieżkę metaboliczną, która pozwoliła mu zsyntetyzować podstawową substancję, niezbędną dla jego procesów życiowych.
Ten niedobór jest generalnie spowodowany mutacją. Mutacja generuje zerowy allel, który nie ma zdolności biologicznej do wytworzenia substancji obecnej w prototrofie.
Indeks artykułów
- 1 Aplikacje
- 1.1 Biochemia
- 1.2 Markery auksotroficzne
- 1.3 Test Amesa
- 1.4 Inne zastosowania testu Amesa
- 2 Odnośniki
Aplikacje
Biochemia
Auksotroficzne markery genetyczne są często używane w genetyce molekularnej. Każdy gen zawiera informację, która koduje białko. Wykazali to badacze George Beadle i Edward Tatum w swojej pracy, która przyniosła im Nagrodę Nobla..
Ta specyficzność genów umożliwia mapowanie szlaków biosyntetycznych lub biochemicznych. Mutacja genu prowadzi do mutacji białka. W ten sposób można określić w auksotroficznych szczepach badanych bakterii, które enzymy są dysfunkcyjne z powodu mutacji..
Inną metodą określania szlaków biosyntezy jest wykorzystanie auksotroficznych szczepów określonych aminokwasów. W takich przypadkach zapotrzebowanie szczepów na takie aminokwasy jest wykorzystywane do dodawania nienaturalnych analogów aminokwasów białek do pożywek hodowlanych..
Na przykład podstawienie fenyloalaniny w miejsce para-azydo-fenyloalaniny w kulturach szczepów Escherichia coli auksotroficzny dla fenyloalaniny.
Markery auksotroficzne
Mutacje w genach kodujących enzymy uczestniczące w szlakach biosyntezy cząsteczek budulcowych metabolizmu są wykorzystywane jako markery w większości eksperymentów genetycznych z drożdżami..
Niedobory żywieniowe spowodowane mutacją (auksotrofią) można zrekompensować dostarczając w pożywce wymaganą substancję odżywczą.
Jednak taka kompensacja niekoniecznie jest ilościowa, ponieważ mutacje wpływają na kilka parametrów fizjologicznych i mogą działać synergistycznie..
Z tego powodu przeprowadzono badania mające na celu uzyskanie szczepów prototroficznych w celu wyeliminowania markerów auksotroficznych i zmniejszenia obciążenia w badaniach fizjologicznych i metabolicznych..
Test Amesa
Test Amesa, zwany także testem mutagenezy Salmonella, został opracowany przez Bruce'a N. Amesa w latach 70. XX wieku w celu ustalenia, czy substancja chemiczna jest mutagenem.
Opiera się na zasadzie mutacji odwrotnej lub późniejszej mutacji. Zatrudnia wiele szczepów Salmonella typhimurium auksotroficzny do histydyny.
Siłę substancji chemicznej wywołującej mutację mierzy się, nakładając ją na bakterie na płytce zawierającej histydynę. Bakterie są następnie przenoszone do nowej płytki nazębnej ubogiej w histydynę..
Jeśli substancja nie jest mutagenna, bakterie nie wykazywałyby wzrostu na nowej płytce nazębnej. W przeciwnym razie histydynowe bakterie auksotroficzne będą mutować z powrotem do histydynowych szczepów prototroficznych..
Porównanie proporcji wzrostu bakterii na płytkach z i bez traktowania umożliwia ilościowe określenie działania mutagennego związku na bakterie..
Ten możliwy efekt mutagenny u bakterii wskazuje na możliwość wywołania takich samych skutków u innych organizmów, w tym u ludzi..
Uważa się, że związek, który jest zdolny do powodowania mutacji w bakteryjnym DNA, może również być zdolny do wytwarzania mutacji, które mogą powodować raka..
Inne zastosowania do testu Amesa
Rozwój nowych szczepów
Do uzyskania nowych szczepów bakterii zastosowano test Amesa. Na przykład opracowano szczepy z niedoborem nitroreduktazy.
Szczepy te są wykorzystywane do badania metabolizmu ksenobiotyków i systemów naprawy DNA. Były również przydatne do oceny mechanizmów metabolicznych nitrogrup do wytwarzania aktywnych mutagenów, a także mechanizmów nitrowania związków genotoksycznych..
Antymutageneza
Test Amesa był również używany jako narzędzie do badania i klasyfikowania naturalnych antymutagenów. Antymutageny to związki, które mogą zmniejszać zmiany mutagenne w DNA, głównie poprzez poprawę ich systemów naprawczych.
W ten sposób takie związki pozwalają uniknąć początkowych etapów rozwoju raka. Od wczesnych lat 80. (XX wieku) Ames i wsp. Przeprowadzali badania oceniające redukcję genotoksyn i ryzyko raka poprzez dietę bogatą w antymutageny..
Zaobserwowali, że populacje, które stosowały dietę z wysokim poziomem antymutagenów, miały mniejsze ryzyko zachorowania na raka żołądka i jelit.
Test Amesa był szeroko stosowany do badania różnych ekstraktów roślinnych, o których wiadomo, że zmniejszają mutagenność. Badania te wykazały również, że składniki roślinne nie zawsze są bezpieczne. Wykazano, że wiele roślin jadalnych ma działanie genotoksyczne.
Wykazano również, że test Amesa jest przydatny w wykrywaniu toksycznych lub antymutagennych skutków naturalnych związków, które są często stosowane w medycynie alternatywnej..
Badania metabolizmu genotoksycznego
Jedną ze słabości testu Amesa był brak aktywacji metabolicznej związków genotoksycznych. Jednak problem ten został rozwiązany poprzez dodanie indukowanych przez CYP homogenatów wątroby przygotowanych z gryzoni..
CYP to hemoproteina związana z metabolizmem różnych substancji. Ta modyfikacja dodała nowe możliwości do testu Amesa. Na przykład zbadano kilka induktorów CYP, wykazując, że enzymy te są indukowane przez różne typy związków..
Ocena mutagenów w płynach biologicznych
Testy te wykorzystują próbki moczu, osocza i surowicy. Może być przydatny do oceny tworzenia się związków N-nitrozowych in vivo z leków aminowych.
Mogą być również przydatne w badaniach epidemiologicznych populacji ludzi narażonych na mutageny zawodowe, nawyki palenia i narażenie na zanieczyszczenia środowiska..
Testy te wykazały na przykład, że pracownicy narażeni na produkty odpadowe mają wyższy poziom mutagenów w moczu niż ci, którzy pracowali w zakładach uzdatniania wody..
Służyło również do wykazania, że stosowanie rękawic zmniejsza stężenia mutagenów u pracowników odlewni narażonych na wielopierścieniowe związki aromatyczne..
Badania mutagenów w moczu są również cennym narzędziem do oceny antymutagennej, ponieważ np. Test ten wykazał, że podawanie witaminy C hamuje tworzenie się związków N-nitrozowych..
Służyło również do wykazania, że spożywanie zielonej herbaty przez miesiąc zmniejsza stężenie mutagenów w moczu..
Bibliografia
- B.N. Ames, J. McCann, E. Yamasaki (1975). Metody wykrywania czynników rakotwórczych i mutagenów za pomocą testu mutagenności na salmonellę / mikrosomy ssaków. Badania mutacji / mutageneza środowiskowa i powiązane tematy.
- B. Arriaga-Alba, R. Montero-Montoya, J.J. Espinosa (2012). Test Amesa w XXI wieku. Badania i recenzje: A Journal of Toxicology.
- Auksotrofia. Na Wikipedii. Odzyskany z https://en.wikipedia.org/wiki/Auxotrophy.
- S. Benner (2001). Encyklopedia genetyki. Academic Press.
- F. Fröhlich, R. Christiano, T.C. Walther (2013). Natywny SILAC: Metaboliczne znakowanie białek mikroorganizmów prototrofów w oparciu o regulację syntezy lizyny. Proteomika molekularna i komórkowa.
- M. Mülleder, F. Capuano, P. Pir, S. Christen, U. Sauer, S.G. Oliver, M. Ralser (2012). Kolekcja prototroficznych mutantów delecyjnych na potrzeby metabolomiki drożdży i biologii systemów. Nature Biotechnology.



Jeszcze bez komentarzy