
Jakie są siły Van der Waalsa?
Plik Siły Van der Waalsa są to siły międzycząsteczkowe o charakterze elektrycznym, które mogą być atrakcyjne lub odpychające. Istnieje interakcja między powierzchniami cząsteczek lub atomów, różniąca się w istocie od wiązań jonowych, kowalencyjnych i metalicznych, które powstają wewnątrz cząsteczek..
Chociaż są słabe, siły te są w stanie przyciągać cząsteczki gazu; także gazów skroplonych i zestalonych oraz wszystkich cieczy i ciał stałych organicznych. Johannes Van der Waals (1873) był tym, który opracował teorię wyjaśniającą zachowanie rzeczywistych gazów.

W tak zwanym równaniu Van der Waalsa dla gazów rzeczywistych - (P + dondwa/ Vdwa) (V - nb)) = nRT - wprowadza się dwie stałe: stałą b (czyli objętość zajmowaną przez cząsteczki gazu) i „a”, która jest stałą empiryczną.
Stała „a” koryguje odchylenie od oczekiwanego zachowania idealnych gazów w niskich temperaturach, dokładnie tam, gdzie wyrażana jest siła przyciągania między cząsteczkami gazu. Zdolność atomu do polaryzacji w układzie okresowym wzrasta od góry do dołu grupy i od prawej do lewej w okresie..
Zwiększając liczbę atomową - a tym samym liczbę elektronów - te, które znajdują się w zewnętrznych powłokach, są łatwiejsze do przemieszczania, tworząc elementy polarne.
Indeks artykułów
- 1 Międzymolekularne oddziaływania elektryczne
- 1.1 Oddziaływanie między stałymi dipolami
- 1.2 Oddziaływanie między dipolem trwałym a dipolem indukowanym
- 2 siły londyńskie lub rozproszenie
- 3 radia Van der Waals
- 4 Siły i energia oddziaływania elektrycznego między atomami i między cząsteczkami
- 5 Referencje
Międzymolekularne oddziaływania elektryczne
Oddziaływanie między stałymi dipolami
Istnieją cząsteczki obojętne elektrycznie, które są stałymi dipolami. Wynika to z zakłócenia w dystrybucji elektronowej, które powoduje przestrzenne oddzielenie dodatnich i ujemnych ładunków w kierunku końców cząsteczki, tworząc dipol (tak jakby był magnesem).
Woda składa się z 2 atomów wodoru na jednym końcu cząsteczki i atomu tlenu na drugim końcu. Tlen ma większe powinowactwo do elektronów niż wodór i przyciąga je.
Powoduje to przemieszczenie elektronów w kierunku tlenu, pozostawiając ten ujemnie naładowany, a wodór z ładunkiem dodatnim..

Ujemny ładunek cząsteczki wody może oddziaływać elektrostatycznie z dodatnim ładunkiem innej cząsteczki wody, powodując przyciąganie elektryczne. Tak więc ten rodzaj oddziaływania elektrostatycznego nazywany jest siłami Keesoma.
Oddziaływanie między stałym dipolem a dipolem indukowanym
Stały dipol ma tak zwany moment dipolowy (µ). Wielkość momentu dipolowego określa wyrażenie matematyczne:
µ = q.x
q = ładunek elektryczny.
x = odległość przestrzenna między biegunami.
Moment dipolowy jest wektorem, który zgodnie z konwencją jest reprezentowany zorientowany od bieguna ujemnego do bieguna dodatniego. Wielkość µ boli wyrazić w debye (3,34 × 10-30 Cm.
Stały dipol może wchodzić w interakcje z obojętną cząsteczką, powodując zmianę jej dystrybucji elektronowej, co powoduje indukowany dipol w tej cząsteczce.
Stały dipol i indukowany dipol mogą oddziaływać elektrycznie, wytwarzając siłę elektryczną. Ten rodzaj interakcji nazywany jest indukcją, a działające na nią siły nazywane są siłami Debye'a..
Siły londyńskie lub rozproszenie
Naturę tych sił przyciągających wyjaśnia mechanika kwantowa. Londyn postulował, że w jednej chwili w cząsteczkach elektrycznie obojętnych środek ujemnych ładunków elektronów i środek dodatnich ładunków jąder może się nie pokrywać..
Zatem fluktuacja gęstości elektronów pozwala cząsteczkom zachowywać się jak tymczasowe dipole.
Nie jest to samo w sobie wyjaśnieniem dla sił przyciągania, ale tymczasowe dipole mogą wywoływać odpowiednio wyrównaną polaryzację sąsiednich cząsteczek, powodując generowanie siły przyciągania. Siły przyciągania generowane przez fluktuacje elektroniczne nazywane są siłami londyńskimi lub rozproszeniem..
Siły Van der Waalsa wykazują anizotropię, dlatego wpływa na nie orientacja cząsteczek. Jednak interakcje typu dyspersyjnego są zawsze przeważnie atrakcyjne..
Siły Londynu stają się silniejsze wraz ze wzrostem rozmiaru cząsteczek lub atomów.
W halogenach cząsteczki F.dwa i Cldwa niskie liczby atomowe to gazy. BRdwa o najwyższej liczbie atomowej jest cieczą, a jadwa, halogen o najwyższej liczbie atomowej jest ciałem stałym w temperaturze pokojowej.
Zwiększenie liczby atomowej zwiększa liczbę obecnych elektronów, co ułatwia polaryzację atomów, a tym samym interakcje między nimi. To decyduje o stanie fizycznym halogenów.
Radia Van der Waalsa
Interakcje między cząsteczkami i między atomami mogą być atrakcyjne lub odpychające, w zależności od krytycznej odległości między ich centrami, która nazywa się rv.
W odległościach między cząsteczkami lub atomami większych niż rv, przyciąganie między jądrami jednej cząsteczki a elektronami drugiej przeważa nad odpychaniem między jądrem a elektronami dwóch cząsteczek.
W opisanym przypadku oddziaływanie jest atrakcyjne, ale co się stanie, jeśli cząsteczki zbliżą się na odległość mniejszą od rv? Wówczas siła odpychająca przeważa nad atrakcyjną, która przeciwstawia się bliższemu zbliżaniu się atomów..
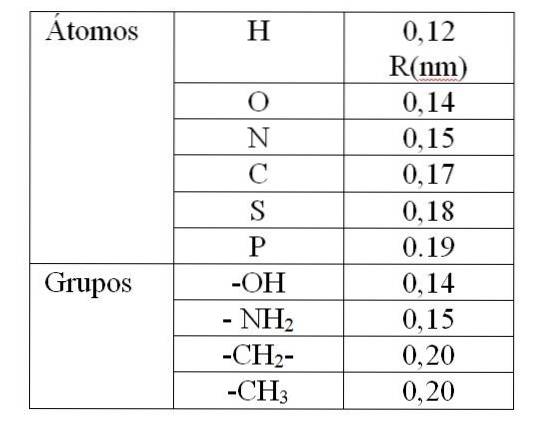
Wartość rv Jest określony przez tak zwane promienie Van der Waalsa (R). Dla sferycznych i identycznych cząsteczek rv równa się 2R. Dla dwóch różnych cząsteczek o promieniu R1 i R.dwa: rv równa się R.1 + Rdwa. Wartości promieni Van der Waalsa podano w tabeli 1.
Wartość podana w Tabeli 1 wskazuje promień Van der Waalsa wynoszący 0,12 nm (10-9 m) dla wodoru. Wtedy wartość rv dla tego atomu jest to 0,24 nm. Dla wartości rv mniej niż 0,24 nm spowoduje odpychanie między atomami wodoru.
Siły i energia oddziaływania elektrycznego między atomami i między cząsteczkami
Siła między parą ładunków q1 i codwa, oddzielone w próżni przez odległość r, określa prawo Coulomba.
F = k. co1.codwa/ rdwa
W tym wyrażeniu k jest stałą, której wartość zależy od użytych jednostek. Jeśli wartość siły - dana przez zastosowanie prawa Coulomba - jest ujemna, oznacza to siłę przyciągania. Wręcz przeciwnie, jeśli wartość podana dla siły jest dodatnia, wskazuje to na siłę odpychającą.
Ponieważ cząsteczki zwykle znajdują się w środowisku wodnym, które osłania wywierane siły elektryczne, konieczne jest wprowadzenie terminu stała dielektryczna (ε). Zatem ta stała koryguje wartość podaną dla sił elektrycznych przez zastosowanie prawa Coulomba.
F = k.q1.codwa/ε.rdwa
Podobnie, energia oddziaływania elektrycznego (U) jest określona przez wyrażenie:
U = k. co1.codwa/ε.r
Bibliografia
- Redaktorzy Encyclopaedia Britannica. (2018). Siły Van der Waalsa. Pobrane 27 maja 2018 z: britannica.com
- Wikipedia. (2017). Siły Van der Waalsa. Pobrane 27 maja 2018 z: es.wikipedia.org
- Kathryn Rashe, Lisa Peterson, Seila Buth, Irene Ly. Siły Van der Waalsa. Pobrane 27 maja 2018 z: chem.libretexts.org
- Morris, J. G. (1974) A Biologist's Physical Chemistry. 2 i wydanie. Edward Arnold (wydawcy) Limited.
- Mathews, C. K., Van Holde, K.E. i Ahern, K.G. (2002) Biochemistry. Trzecia edycja. Addison Wesley Longman, Inc..



Jeszcze bez komentarzy