
Co to są pierwiastki dwuatomowe? (Przykłady)
Plik elementy dwuatomowe, Nazywane również homojądrowymi cząsteczkami dwuatomowymi, składają się tylko z dwóch atomów tych samych pierwiastków chemicznych. Niektóre pierwiastki nie mogą istnieć samodzielnie, nawet gdy są odizolowane od jakiegokolwiek innego typu atomu.
Elementy tego rodzaju będą łączyć się z atomami tego samego pierwiastka, aby były stabilne. Innymi słowy, wodór, pierwiastek dwuatomowy, nie może być sam w sobie. Nie może po prostu istnieć H..
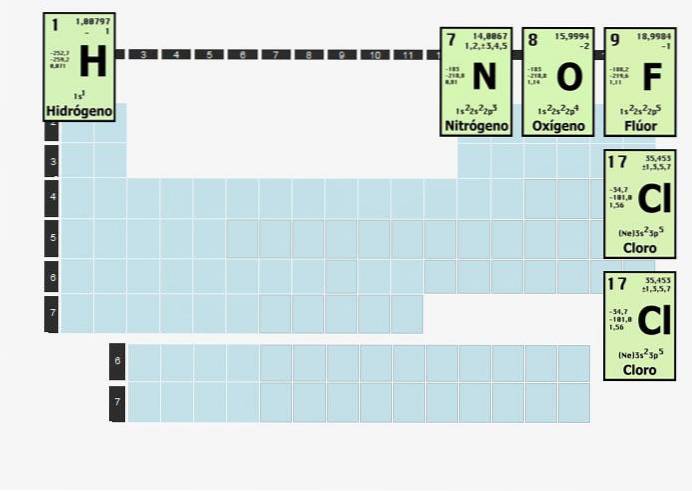
Wodór jest tak reaktywny, że gdy zostanie wyizolowany ze wszystkiego oprócz wodoru, połączy się w dwuatomową (dwuatomową) cząsteczkę. Stąd wodór, który czasami jest używany jako paliwo, występuje jako H.dwa.
Cząsteczki dwuatomowe
Cząsteczki dwuatomowe zawierają dwa atomy, które są związane chemicznie. Jeśli dwa atomy są identyczne, na przykład cząsteczka tlenu (Odwa), tworzy homojądrową cząsteczkę dwuatomową, natomiast jeśli atomy są różne, tak jak w cząsteczce tlenku węgla (CO), tworzy heterojądrową cząsteczkę dwuatomową.
Cząsteczki zawierające więcej niż dwa atomy nazywane są cząsteczkami wieloatomowymi, na przykład dwutlenkiem węgla (COdwa) i wodę (H.dwaLUB). Cząsteczki polimeru mogą zawierać wiele tysięcy atomów składowych.
Cząsteczki dwuatomowe tworzą siedem elementów. Następujące 5-elementowe gazy występują jako cząsteczki dwuatomowe w temperaturze i ciśnieniu pokojowym:
-Wodór - H.dwa
-Azot - Ndwa
-Tlen - Odwa
-Fluorki - F.dwa
-Chlor - Cldwa
Brom i jod występują powszechnie w postaci płynnej, ale także w postaci gazów dwuatomowych w nieco wyższych temperaturach, co daje łącznie 7 pierwiastków dwuatomowych..
-Brom - Brdwa
-Jod - Idwa
Pierwiastki dwuatomowe to halogeny (fluor, chlor, brom, jod) oraz pierwiastki z końcówką -gen (wodór, tlen, azot). Astatyna to kolejny halogen, ale jego zachowanie jest nieznane..
Właściwości pierwiastków dwuatomowych
Wszystkie cząsteczki dwuatomowe są liniowe, co jest najprostszym przestrzennym układem atomów.
Dogodne i powszechne jest przedstawianie cząsteczki dwuatomowej jako dwóch mas punktowych (dwóch atomów) połączonych bezmasową sprężyną..
Energie zaangażowane w ruchy cząsteczki można podzielić na trzy kategorie:
- Energie translacyjne (cząsteczka przemieszczająca się z punktu A do punktu B)
- Energie rotacyjne (cząsteczka obracająca się wokół własnej osi)
- Energie wibracyjne (cząsteczki, które wibrują na różne sposoby)
Wszystkie pierwiastki dwuatomowe są gazami w temperaturze pokojowej, z wyjątkiem bromu i jodu, które są ciekłe (jod może być nawet w stanie stałym), a wszystkie z wyjątkiem tlenu i azotu są połączone pojedynczym wiązaniem..
Cząsteczka tlenu ma dwa atomy połączone wiązaniem podwójnym, a cząsteczkę azotu wiązaniem potrójnym.
Niektóre elementy dwuatomowe
Wodór
Wodór (H.dwa), o liczbie atomowej 1, jest bezbarwnym gazem, który nie został formalnie odkryty jako pierwiastek przez Henry'ego Cavendisha do 1766 roku, ale został przypadkowo znaleziony około sto lat wcześniej przez Roberta Boyle'a.
Jest to bezbarwny, bezwonny, nietoksyczny gaz, który naturalnie występuje w naszym Wszechświecie. Będąc pierwszym pierwiastkiem układu okresowego, wodór jest najlżejszym i najbardziej rozpowszechnionym ze wszystkich pierwiastków chemicznych we wszechświecie, ponieważ stanowi 75% jego masy..
Azot
Azot (Ndwa) ma liczbę atomową siedem i stanowi około 78,05% objętości atmosfery ziemskiej.
Jest to gaz bezwonny, bezbarwny i przeważnie obojętny, w stanie ciekłym pozostaje bezbarwny i bezwonny..

Tlen
Tlen (Odwa) ma liczbę atomową osiem. Ten bezbarwny, bezwonny gaz ma w jądrze osiem protonów i jest bladoniebieski w stanie ciekłym i stałym..
Jedna piąta ziemskiej atmosfery składa się z tlenu i jest to trzeci pod względem masy pierwiastek we wszechświecie..
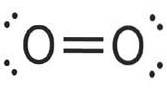
Tlen jest pierwiastkiem występującym masowo w biosferze Ziemi w największej ilości. Wysokie stężenie tlenu w atmosferze jest wynikiem cyklu tlenowego Ziemi, który jest napędzany głównie przez fotosyntezę u roślin..
Fluor
Fluor (F.dwa) ma liczbę atomową dziewięć i jest najbardziej reaktywnym i elektroujemnym ze wszystkich pierwiastków. Ten niemetaliczny pierwiastek to bladożółty gaz należący do grupy halogenowej.
George Gore był najwyraźniej pierwszym naukowcem, który wyodrębnił fluor, ale jego eksperyment eksplodował, gdy wytworzony fluor zareagował z wodorem..
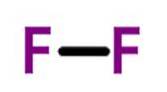
W 1906 roku Ferdynand Frederic Henri Moissan otrzymał Nagrodę Nobla w dziedzinie chemii za swoją pracę nad izolacją fluoru w 1886 roku. Jest to najbardziej elektroujemny pierwiastek układu okresowego..
Chlor
Chlor (Cldwa) jest członkiem grupy halogenowej o liczbie atomowej siedemnastu. Jedna z jego form, NaCl, jest używana od czasów starożytnych.

Chlor był używany od tysięcy lat w wielu innych formach, ale został nazwany dopiero w 1810 roku przez Sir Humphry'ego Davy'ego..
Chlor w czystej postaci jest żółtawozielony, ale jego typowe związki są zazwyczaj bezbarwne..
Brom
Brom (Brdwa) ma liczbę atomową trzydzieści pięć. Jest to ciężka, ciemnobrązowa ciecz, jedyny niemetaliczny pierwiastek będący cieczą.

Brom został odkryty przez Antoine J. Balard w 1826 roku. Był używany do ważnych celów na długo przed formalnym odkryciem..
Jod
Jod (Idwa) ma liczbę atomową pięćdziesiąt trzy, z pięćdziesięcioma trzema protonami w jądrze atomu. Jest to niebiesko-czarny niemetal, który odgrywa bardzo ważną rolę w chemii organicznej..
Jod został odkryty w 1811 roku przez Barnarda Courtoisa. Nazwał go jodem od greckiego słowa „jodes”, które oznacza fiolet. Jest to jednolity niebiesko-czarny.
Jod odgrywa bardzo ważną rolę w biologii wszystkich organizmów żywych, ponieważ jego niedobór prowadzi do chorób takich jak nadczynność i niedoczynność tarczycy.
Bibliografia
- (S.F.). Homonuklearne cząsteczki dwuatomowe. Odzyskany z boundless.com.
- Fakty dotyczące chloru. (S.F.). Odzyskany z softschools.com.
- Elementy dwuatomowe. (S.F.). Odzyskany z ths.talawanda.org.
- Encyclopædia Britannica. (14 września 2016). Cząsteczka. Odzyskany z britannica.com.
- Helmenstine, A. (28 września 2014). Elementy dwuatomowe. Odzyskany z sciencenotes.org.
- Helmenstine, A.M. (29 marca 2017). Co to jest siedem elementów dwuatomowych? Odzyskany z thinkco.com.
- Fakty dotyczące tlenu. (S.F.). Odzyskany z softschools.com.
- Królewskie Towarzystwo Chemii. (2015). jod molekularny. Odzyskany z chemspider.com.



Jeszcze bez komentarzy