
Odwracalne charakterystyki i przykłady reakcji

ZA odwracalna reakcja To taki, który w pewnym momencie swojego przebiegu osiąga stan równowagi, w którym stężenia reagentów i produktów pozostają stałe; to znaczy nie zmieniają się, ponieważ prędkość, z jaką jedna jest konsumowana, jest taka sama, z jaką pojawia się druga. Mówi się również, że taki stan odpowiada równowadze dynamicznej.
Jednak równowagę można postrzegać jako konsekwencję odwracalności reakcji chemicznej; ponieważ w nieodwracalnych reakcjach niemożliwe jest ustalenie jakiejkolwiek równowagi. Aby tak się stało, produkty muszą być w stanie reagować ze sobą w określonych warunkach ciśnienia i temperatury, powodując powrót reagentów..
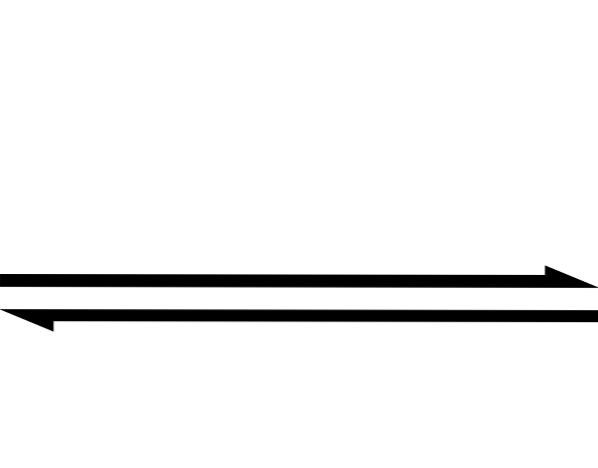
Powyższe jest nadmiernie uproszczone przez użycie symbolu podwójnej strzałki (z dwoma antyrównoległymi głowicami). Kiedy widzimy to w równaniu chemicznym, oznacza to, że reakcja przebiega w obu kierunkach: od lewej do prawej (tworzenie produktów) i od prawej do lewej (tworzenie reagentów lub reagentów).
Mniejszość reakcji chemicznych jest odwracalna i występują one głównie w syntezach organicznych i nieorganicznych. W tych przypadkach niezwykle ważne jest, aby wiedzieć, jakie warunki sprzyjają równowadze, aby oszacować ilości produktu, które można uzyskać..
Indeks artykułów
- 1 Charakterystyka reakcji odwracalnych
- 1.1 Ogólne równanie i równowaga
- 1.2 Zasada Le Châtelier
- 1.3 Zmiany chemiczne
- 1.4 Gatunki chemiczne
- 2 Przykłady reakcji odwracalnych
- 2.1 Roztwór chlorku kobaltu
- 2.2 Jodowodór
- 2.3 Hydroliza
- 2.4 Roztwór chromianowo-dichromianowy
- 2,5 Amoniak
- 2.6 Estryfikacja
- 3 Odnośniki
Charakterystyka reakcji odwracalnych
Równanie ogólne i równowaga
Odwracalna reakcja ma następujące ogólne równanie, biorąc pod uwagę, że istnieją tylko dwa reagenty, A i B:
A + B ⇌ C + D
Podwójna strzałka wskazuje, że A i B reagują tworząc C i D, ale także C i D mogą reagować ze sobą w celu regeneracji reagentów; to znaczy, zachodzi reakcja w przeciwnym kierunku, od prawej do lewej.
W reakcji bezpośredniej powstają produkty, podczas gdy odwrotna reaktywna. Jeśli jedna jest egzotermiczna, druga musi logicznie być endotermiczna i obie pojawiają się spontanicznie; ale niekoniecznie z tą samą prędkością.
Na przykład A i B mogą być mniejsze lub niestabilne niż C i D; i dlatego są zużywane szybciej niż C, a D może je zregenerować.
Jeśli produkty C i D ledwo reagują ze sobą, nastąpi większa akumulacja produktów niż reagentów. Oznacza to, że po osiągnięciu równowagi chemicznej będziemy mieli wyższe stężenia C i D niż A lub B, niezależnie od tego, czy ich stężenia się nie różnią..
Mówi się, że równowaga zostanie przesunięta w lewo, gdzie będzie więcej produktów niż reagentów.
Zasada Le Châtelier
Odwracalna reakcja charakteryzuje się tym, że zachodzi w obu kierunkach w równaniu chemicznym, dochodzi do punktu równowagi i odpowiada na zewnętrzne zmiany lub wpływy zgodnie z zasadą le Châteliera.
W rzeczywistości, dzięki tej zasadzie, można było wyjaśnić obserwacje Bertholleta w 1803 roku, kiedy rozpoznał kryształy Na.dwaWSPÓŁ3 w piaszczystym jeziorze położonym w Egipcie. Reakcja podwójnego przemieszczenia wyglądałaby następująco:
NadwaWSPÓŁ3(ac) + CaCldwa(ac) ⇌ NaCl (aq) + CaCO3(ac)
Aby nastąpiła reakcja odwrotna, musi występować nadmiar NaCl, a zatem równowaga przesunęłaby się w prawo: w kierunku tworzenia się NadwaWSPÓŁ3.
Ta cecha ma ogromne znaczenie, ponieważ w ten sam sposób manipuluje się ciśnieniami lub temperaturami, aby sprzyjać kierunkowi reakcji generowanej przez interesujący gatunek..
Zmiany chemiczne
Zmiany chemiczne w przypadku reakcji odwracalnych wydają się być mniej oczywiste niż w przypadku reakcji nieodwracalnych. Istnieją jednak reakcje, zwłaszcza te z udziałem kompleksów metali, w których obserwujemy zmiany koloru zależne od temperatury..
Gatunki chemiczne
W odwracalnej reakcji może brać udział dowolny rodzaj związku. Okazało się, że dwie sole są zdolne do ustanowienia równowagi, NadwaWSPÓŁ3 i CaCldwa. To samo dzieje się w przypadku kompleksów lub cząsteczek metali. W rzeczywistości wiele odwracalnych reakcji jest spowodowanych cząsteczkami ze specyficznymi wiązaniami, które wielokrotnie pękają i regenerują się..
Przykłady reakcji odwracalnych
Roztwór chlorku kobaltu
Roztwór chlorku kobaltu, CoCldwa, w wodzie zabarwia go na różowo, ze względu na tworzenie się złożonego roztworu wodnego. Po podgrzaniu tego roztworu kolor zmienia się na niebieski, dając następującą odwracalną reakcję:
[Co (H.dwaLUB)6]dwa+(ac) (różowy) + 4Cl-(ac) + Q ⇌ CoCl4dwa-(ac) (niebieski) + 6HdwaO (l)
Gdzie Q to dostarczane ciepło. To ciepło odwadnia kompleks, ale gdy roztwór ostygnie lub jeśli zostanie dodana woda, powróci on do swojego pierwotnego różowego koloru..
Jodowodór
Następująca reakcja odwracalna jest prawdopodobnie najbardziej klasyczną we wprowadzaniu pojęcia równowagi chemicznej:
H.dwa(g) + Idwa(s) ⇌ 2HI (g)
Zauważ, że reakcja udaje się ustalić równowagę nawet wtedy, gdy jod jest w stanie stałym. Wszystkie gatunki są molekularne: H-H, I-I i H-I.
Hydroliza
Hydroliza to bardzo reprezentatywne przykłady odwracalnych reakcji. Wśród najprostszych mamy ten, który poddawany jest sprzężeniu z kwasem lub zasadą. Hydroliza jonu amonowego, NH4+, i jon węglanowy CO3dwa-, są następujące:
NH4+(ac) + HdwaO (l) ⇌ NH3(g) + OH-
WSPÓŁ3dwa-(ac) + HdwaO (l) ⇌ HCO3-(ac) + OH-
Jeśli dodamy bazę, która dostarcza jony OH- do środka przesuniemy oba salda w lewo.
Roztwór chromianowo-dichromianowy
Bardzo podobnie jak w pierwszym przykładzie, roztwór chromianu ulega zmianie koloru, ale z powodu zmian temperatury, ale nie pH. Odwracalna reakcja to:
2CrO4dwa-(ac) (żółty) + 2H3LUB+(ac) ⇌ KrdwaLUB7dwa-(ac) (pomarańczowy) + 3HdwaO (l)
Więc jeśli do żółtego roztworu CrO4dwa- jeśli zostanie zakwaszony jakimkolwiek kwasem, jego kolor natychmiast zmieni się na pomarańczowy. A jeśli zostanie następnie zalkalizowana lub zostanie dodana obfita woda, równowaga przesunie się w prawo, ponownie pojawi się żółty kolor i zostanie zużyty Cr.dwaLUB7dwa-.
Amoniak
Synteza amoniaku, NH3, Obejmuje odwracalną reakcję, dostosowaną tak, że gazowy azot, bardzo obojętny rodzaj, reaguje:
Ndwa(g) + 3Hdwa(s) ⇌ 2NH3(sol)
Estryfikacja
Na koniec wymieniony jest przykład chemii organicznej: estryfikacja. Polega to na uzyskaniu estru z kwasu karboksylowego i alkoholu w silnie kwaśnym środowisku. Odwracalna reakcja to:
RCOOH + R'OH ⇌ RCOOR '+ HdwaLUB
Bibliografia
- Whitten, Davis, Peck & Stanley. (2008). Chemia. (8th ed.). CENGAGE Learning.
- Walter J. Moore. (1963). Chemia fizyczna. W kinetyce chemicznej. Wydanie czwarte, Longmans.
- Ira N. Levine. (2009). Zasady fizykochemii. Wydanie szóste, str. 479–540. Mc Graw Hill.
- Wikipedia. (2020). Odwracalna reakcja. Odzyskane z: en.wikipedia.org
- Helmenstine, dr Anne Marie (19 sierpnia 2019). Definicja i przykłady odwracalnej reakcji. Odzyskany z: thinkco.com
- Binod Shrestha. (05 czerwca 2019). Odwracalne i nieodwracalne reakcje. Chemia LibreTexts. Źródło: chem.libretexts.org
- David Wood. (2020). Odwracalne reakcje chemiczne: definicja i przykłady. Nauka. Odzyskany z: study.com



Jeszcze bez komentarzy